
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 吸热反应只有在加热的条件下才能进行 | |
| C. | 放热反应可能需要在加热的条件下才能进行 | |
| D. | 化学反应中的能量变化都只以热能的形式表现出来 |
分析 A.物理变化也常伴随着能量的变化;
B.吸热反应与放热反应取决于反应物与生成物总能量的关系,与反应条件无关;
C.铝热反应为放热反应,但需要在高温下进行;
D.化学反应中的能量变化主要以热能的形式表现出来.
解答 解:A.化学变化中伴随着能量的变化,物理变化也常伴随着能量的变化,故A错误;
B.氯化铵结晶水合物与氢氧化钡固体的反应为吸热反应,但在常温下可进行,故B错误;
C.铝热反应为放热反应,但需要在高温下进行,很多放热反应在较高温度下才能进行,故C正确;
D.化学反应中的能量变化主要以热能的形式表现出来,故D错误;
故选C.
点评 本题考查化学反应与能量变化,注意常见吸热反应和放热反应,注意吸热反应与放热反应取决于反应物与生成物总能量的关系,与反应条件无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
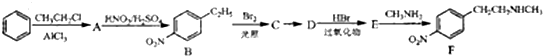
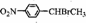 .
.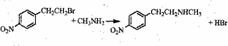 .
.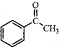 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线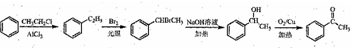 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
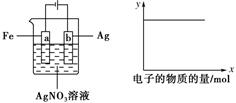
| A. | ①②⑤ | B. | ③④ | C. | ①②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
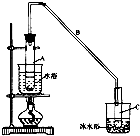 环己烯是一种重要的化工原料.
环己烯是一种重要的化工原料. .
.| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11 | |
| B. | 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 | |
| C. | 分别加水稀释10倍、四种溶液的pH:①>②>③>④ | |
| D. | 将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
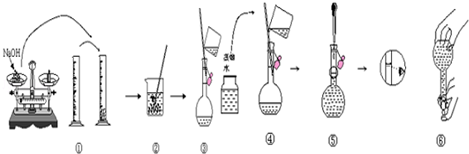
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com