
【题目】下列物质中属于电解质的是( )
A.氯化氢
B.酒精
C.三氧化硫
D.铁
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定条件下达到平衡状态,t1时刻改变条件,反应速率与时间关系如右图,下列说法正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,t1时刻改变条件,反应速率与时间关系如右图,下列说法正确的是

A.维持温度不变,t1时扩大容积
B.维持压强不变,t1时升高温度
C.维持温度和压强不变,t1时充入SO3(g)
D.维持温度与容积不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1升甲气体和2升乙气体恰好完全化合生成2升丙气体(同温同压),若丙气体的分子式为YX2 , 则甲和乙的分子式依次为( )
A.X2 与Y2
B.XY 与X2
C.X2 与YX
D.YX 与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的病因在于关节滑液中形成了尿酸钠(NaUr)晶体,尤其在寒冷季节诱发关节疼痛,其化学机理为:
①HUr(尿酸)+H2O![]() Ur-(尿酸根离子)+H3O+ Ka(37℃)=4.0×10-6
Ur-(尿酸根离子)+H3O+ Ka(37℃)=4.0×10-6
②Ur-(aq)+Na+(aq)![]() NaUr(s)
NaUr(s)
回答下列问题:
(1)降低温度,平衡①向 (填“左”或“右”,下同)移动;若加水稀释,平衡②向 移动。
(2)37℃时,1.0 L水中最多可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为 。
(3)关节炎发作多在脚趾和手指的关节处,因为这些部位的温度一般较低。这说明温度降低时,尿酸钠的Ksp________(填“增大”,“减小”或“不变”);注意关节的防寒保暖,可缓解关节炎导致的疼痛,说明反应②的△H 0(填“>”或“<”)
(4)37℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.50×10-3mol/L,其中尿酸分子的浓度为5.00×10-4mol/L,该病人尿液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在标号元素中,最活泼的金属元素是____。最活泼的非金属元素是____。(写元素符号)⑨元素的离子结构示意图是____________________。
(2)①与②形成共价化合物的电子式________________。用电子式表示⑤与⑨形成化合物的形成过程__________________________________________。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是________。(写元素符号)
(4)⑦、⑧、⑨三种元素所形成的气态氢化物中,最稳定的氢化物是____(写分子式);其三种元素的最高价含氧酸的酸性由强到弱的顺序 _________。(写酸的分子式)
(5)写出⑥元素的单质与氢氧化钠反应的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是( )
A. 在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质
B. 因SO2具有氧化性,故可用于漂白纸浆
C. 刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐
D. 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
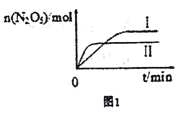
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
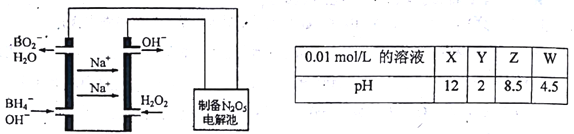
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com