


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、将氯气通入氯化亚铁溶液:Fe2++Cl2=Fe3++Cl- |
| B、氯气通入水:Cl2+H2O=2H++Cl-+ClO- |
| C、氯化铝溶液中通入过量的氨水:Al3++3OH-=Al(OH)3 |
| D、氯气通入烧碱溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
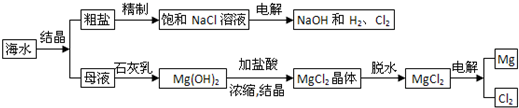
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示:
现有甲、乙、丙、A、B、C六种物质,其中甲、乙、丙是由短周期元素组成的单质.一定条件下转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用 0.1mol?L-1HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用 0.1mol?L-1HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) |
| B、当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C、当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Na+、Cl-、NO3- |
| B、Ba2+、Al3+、Cl-、NO3- |
| C、K+、Na+、HCO3-、Cl- |
| D、AlO2-、K+、OH-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com