
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是( )
A.78g 由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA
B.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】环境问题已成为全球普遍的热门话题。
(1)氮氧化物是空气的主要污染源之一。可利用甲烷催化还原氮氧化物。已知:
CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH1= -867 kJ·mol-1
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH2= -564 kJ·mol-1
则CH4将NO还原为N2的热化学方程式为 。
(2)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。催化反硝化法中,用H2在催化剂表面将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为 。

(3)居室装修材料会挥发出甲醛,污染空气。通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,其负极电极反应式为 。
(4)排放到大气中的SO2会形成硫酸型酸雨,SO2形成酸雨的化学方程式为 。燃煤火电发电厂的尾气中含SO2,常用Na2SO3溶液或氨水吸收尾气,生成NaHSO3 或NH4HSO3,已知NaHSO3溶液显酸性,则其溶液中离子浓度大小关系为 。
(5)已知25℃时,Ksp(BaSO4) =1.0 ×10-10mol2·L-2 。现将4.0×10-4mo1/L 的Na2SO4 溶液与一定浓度的BaCl2溶液等体积混合生成沉淀,计算应加入BaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA
B. 1 mol甲基(—CH3)所含的电子总数为9NA[
C. 0.5 mol 1, 3-丁二烯分子中含有C=C双键数为 NA
D. 28g乙烯所含共用电子对数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一种溶液中加入另一种溶液后,溶液的颜色会发生明显变化的是( )
A. 硫酸亚铁溶液中滴加硫氰化钾溶液 B. 稀醋酸溶液中滴加酚酞指示剂
C. 硫酸铜溶液中滴加硝酸钡溶液 D. 溴水中滴加亚硫酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O
B.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
D.氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与所得结论一致的是
实验操作 | 现象 | 结论 | |
A | 向盛有25mL 沸水的烧杯中滴入5~6滴FeCl3饱和溶液,继续煮沸。 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液。 | 前者溶液变蓝,后者有黄色沉淀。 | KI3溶液中存在平衡:I3- |
C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液中。 | 酸性KMnO4溶液褪色。 | 一定产生了乙烯。 |
D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液。 | 溶液褪色。 | CaCl2溶液有酸性。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染。
(1)已知:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H3= 。
N2(g)+CO2(g)+2H2O(g) △H3= 。
(2)反应③在热力学上趋势很大,其原因是 。在固定容器中按一定比例混合CH4与NO2后,提高NO2转化率的反应条件是 。
(3)在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应③,测得有关数据如下表:
实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
① 开展实验1和实验2的目的是 。
② 130℃时,反应到20分钟时,NO2的反应速率是 。
③ 180℃时达到平衡状态时,CH4的平衡转化率为 。
④ 已知130℃时该反应的化学平衡常数为6.4,试计算a= 。
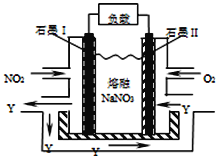
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图。该电池在使用过程中石墨I电极上生成氧化物Y,该电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是
A. 能与氯化氢发生加成反应,只生成一种产物 B. 分了中所有原子在同一平面上
C. 分子中3个碳原子在同一直线上 D. 能发生加聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com