
【题目】某同学设计如下原电池,其工作原理如图所示。下列说法不正确的是
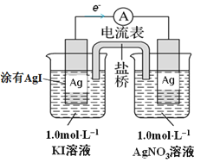
A. 该装置将化学能转化为电能
B. 负极的电极反应是:Ag +I--e-=AgI
C. 电池的总反应是Ag+ +I-=AgI
D. 盐桥(含KNO3的琼脂)中NO3-从左向右移动
【答案】D
【解析】
图中没有外接电源,反而是有个电流表,且电路中有电子的移动方向,则该装置是原电池装置。由于只有Ag+能和I-离子反应,所以电池的总反应是Ag+ +I-=AgI,负极反应为:Ag +I--e-=AgI,正极反应为:Ag++e-=Ag。
A. 经分析,该装置是原电池装置,则该装置将化学能转化为电能,A正确;
B. 根据电子的移动方向,可以推断出左侧电极为负极,该电极反应为:Ag +I--e-=AgI,B正确;
C. 该电池中,表观上看,只有Ag+和I-反应,所以总反应是Ag+ +I-=AgI,C正确;
D. 左侧电极为负极,右侧电极为正极,NO3-带负电荷,向负极移动,所以应该是从右向左移动,D错误;
故合理选项为D。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,下列反应的平衡常数数值如下:
2NO(g) N2(g)+ O2(g) K1=1×1030
2H2(g)+ O2(g) 2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+ O2(g) K3=4×10﹣92
以下说法正确的是( )
A. NO分解产生O2的反应的平衡常数表达式K1=c(N2)c(O2)/c(NO)
B. 水分解产生O2,此时平衡常数的数值约为5×10﹣80
C. NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D. 以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
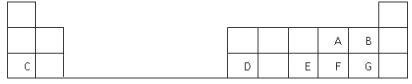
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有500 mL 1 mol·L-1的H2SO4溶液,下列操作及结论正确的是
A.取出50mL该溶液,其中c(SO![]() )=0.1 mol·L-1
)=0.1 mol·L-1
B.取出50mL该溶液,加入足量的BaCl2溶液,完全反应,可得11.65gBaSO4沉淀
C.取出100mL该溶液,加入足量的锌粒,充分反应,所得气体的体积为2.24L
D.取出50mL该溶液,加蒸馏水配制成100 mL溶液,c(H+)=2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,由这四种元素形成的一种盐溶液,遇到FeCl3溶液呈现血红色,该盐溶液与NaOH在加热条件下会生成一种能使湿润的红色石蕊试纸变蓝的气体。下列说法正确的是( )
A.W和X形成的化合物在常温下均为气态
B.X元素可以形成多种具有广泛用途的单质
C.X和Z的最高价氧化物对应水化物都是强酸
D.Y的简单离子与Z的简单离子具有相同的电子层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究稀H2SO4对溶液中的I—被O2 氧化的影响因素。
(1)为了探究c(H+)对反应速率的影响,进行实验:
10mL 1mol· L-1 KI溶液5滴淀粉溶液 | 序号 | 加入试剂 | 变色时间 |
Ⅰ | 10mL蒸馏水 | 长时间放置,未见明显变化 | |
Ⅱ | 10mL 0.1mol· L-1H2SO4溶液 | 放置3min后,溶液变蓝 | |
Ⅲ | 10mL 0.2mol· L-1H2SO4溶液 | 放置1min后,溶液变蓝 | |
Ⅳ | 10mL 0.1mol· L-1K2SO4溶液 | 长时间放置,未见明显变化 |
① 写出实验Ⅱ发生反应的离子方程式 ______。
② 实验Ⅰ~Ⅲ所得结论:_______。
③ 增大实验Ⅱ反应速率还可以采取的措施 ______。
④ 实验Ⅳ的作用是______。
(2)为探究c(H+)除了对反应速率影响外,是否还有其他影响,提出假设:
ⅰ. 增大c(H+),增强O2的氧化性;
ⅱ. 增大c(H+),_______。
小组同学利用下图装置设计实验方案,对假设进行验证。
| 序号 | 溶液a | 溶液b | 现象 |
Ⅴ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 | |
Ⅵ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 1mL 0.2mol·L-1H2SO4溶液 9mL H2O | 指针 偏转 | |
Ⅶ | X | 10mL 0.1mol·L-1K2SO4溶液 10mL 0.2mol·L-1H2SO4溶液 | Y | |
Ⅷ | Z | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 |
通过实验证实假设ⅰ合理,将表中空白处的试剂或现象补充完整。
X __________;Y _________;Z __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究铁被海水腐蚀的实验装置。图2中M是某种与铁片紧贴的金属,下列说法正确的是

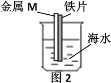
A.图1铁片靠近烧杯底部的部分,腐蚀更严重
B.若M是锌片,可保护铁
C.若M是铜片,可保护铁
D.M是铜或是锌都不能保护铁,是因没有构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③C.②④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com