
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的木炭与CO2反应 | D.甲烷在O2中的燃烧反应 |
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:单选题
高锰酸钾溶液在酸性条件下可以与亚铁离子反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+= Mn2++ Fe3++ H2O
下列有关说法正确的是( )
| A.MnO4-和H+是氧化剂,Fe2+是还原剂 |
| B.H2O既是氧化产物又是还原产物 |
| C.每生成1mol水将转移1.2 mol的电子 |
| D.Fe2+的还原性强于Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是:( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2===2ClO2+__________。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O +I2===S4O
+I2===S4O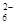 +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示: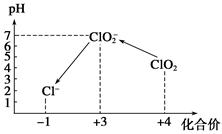
请回答:
①操作Ⅰ中反应的离子方程式是______________________________。
②确定操作Ⅱ完全反应的现象是______________________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是__________________。
④若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12 分)(原创)部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁能在稀硝酸中溶解: →Fe(NO3)3+NO↑+2H2O
→Fe(NO3)3+NO↑+2H2O
24.在上述方程式上标出电子转移的方向和数目。
25.该反应中被还原的元素是 ,还原剂是 。
26.若有0.1 mol铁参加反应,被还原的HNO3为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2和11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com