
���Ǵ����к����������壬�о������仯�������������Ҫ�����塣
��1���ϳɰ���ԭ��Ϊ��N2(g)+3H2(g) 2NH3 (g) ��H=" -" 92.4kJ/mol
2NH3 (g) ��H=" -" 92.4kJ/mol
�ٽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬ƽ��ʱ���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
���¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
�������H2��ת���ʣ����д�ʩ���е��� ��
a���������а�ԭ�����ٳ���ԭ����
b�����������ٳ����������
c���ı䷴Ӧ�Ĵ���
d��Һ��������������
��2����2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) 2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g)��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��___________��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬���� _________��
a��v(NO2)=2v(O2)
b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2)
d�������ڵ��ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
��3������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣
4CO(g)��2NO2(g) 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1
���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
��1���� 33.3% ��2�֣� K=3.7��L/mol��2��100/27��L/mol��2��2�֣�
��ad��2�֣�
��2���� 1.5��10��3mol/(L��s)��2�֣� ��b c ��2�֣� ��c��1�֣�
��3���� ��1�֣�
���������������1������������ʽ���м��㣺N2(g) + 3H2(g) 2NH3(g)
2NH3(g)
��ʼŨ�ȣ�mol?L?1�� 0.15 0.45 0
��ʼŨ�ȣ�mol?L?1�� 0.05 0.15 0.1
��ʼŨ�ȣ�mol?L?1�� 0.1 0.3 0.1
��H2��ת����=0.15mol/L��0.45mol/L��100%=33.3%�����¶��¸÷�Ӧ��ƽ�ⳣ��K��(0.1mol?L?1)2��[0.1mol/L��(0.3mol?L?1)3]= 3.7��L/mol��2��
��a���������а�ԭ�����ٳ���ԭ������ѹǿ����ƽ�������ƶ���H2��ת����������ȷ��b�����������ٳ���������壬ƽ�ⲻ�ƶ���H2��ת���ʲ��䣬����c���ı䷴Ӧ�Ĵ�����ƽ�ⲻ�ƶ���H2��ת���ʲ��䣬����d��Һ����������������ƽ�������ƶ���H2��ת����������ȷ��
��2���ٸ���ͼ���и�����Ũ�ȸı䣬��֪aΪNO2��bΪNO��cΪO2�ģ���0��2s�ڸ÷�Ӧ��ƽ������v(O2)=(0.005mol?L?1-0.002mol?L?1)��2s=1.5��10��3mol/(L��s)
��a��v(NO2)=2v(O2)��û��ע������Ӧ�����淴Ӧ������b������������䣬����ѹǿ���ֲ����˵����Ӧ�ﵽƽ�⣬��ȷ��c��v��(NO)��2v��(O2)��˵������Ӧ���ʵ����淴Ӧ���ʣ���Ӧ�Ѵﵽƽ�⣬��ȷ��d������������������Ϊ��ֵ�����������ڵ��ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ�⣬����
��a����ʱ�����NO2���壬��Ӧ���ʼ�С������b����Ϊ����ӦΪ���ȷ�Ӧ�������ʵ������¶�ƽ�����淴Ӧ�����ƶ�������c. ����O2��Ũ��, ��Ӧ����������ƽ��������Ӧ�����ƶ�����ȷ��d��ѡ���Ч�Ĵ�����ƽ�ⲻ�ƶ�������
��3���¶�������T2������Ӧ���ʺ��淴Ӧ���ʶ�����v����v�����������������Լ�ͼ����T2�¶ȸߣ���Ӧ���ʴ�ƽ�����淴Ӧ�����ƶ���NO2��ת���ʼ�С����ͼ����ȷ��ѹǿ����ƽ��������Ӧ�����ƶ���CO�����������С����ͼ������
���㣺���⿼�黯ѧƽ����жϡ���ѧƽ���ƶ�����Ӧ�����뼰��ѧƽ��ļ��㡢ͼ��ķ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
10000Cʱ�������ƿ�������������Ӧ:

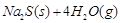 ����ش��������⣺
����ش��������⣺
��1��������Ӧ��ƽ�ⳣ������ʽΪ�� ��
��2��������Ӧ��������ͬ�����½��У�����H2��Ũ����ʱ��ı仯��ͼ��ʾ��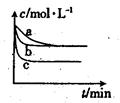
��������a�Ƚϣ�b��c�ֱ���ı�һ�ַ�Ӧ������������b�ı������Ϊ
�ڸ÷�Ӧ�ġ�H___0�����������������=���������ж������� ��
��3�����¶��£���2Lʢ��1.42g Na2SO4���ܱ�������ͨ��H2,5min����
��������Ϊ1.10g�����ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(H2)= ��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ������ĸ����ͬ����
a.������ѹǿ���ֲ���
b.�����������ܶȱ��ֲ���
c.c(H2)=c(H2O)d.v��(H2)=v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����ᴿ�����ٵķ�Ӧԭ��ΪW(s)��I2(g) WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��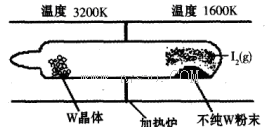
�ٷ�Ӧ(I)��ƽ�ⳣ������ʽK��_______����K��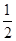 ����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
�ڷ�Ӧ(I)�ġ�H____0���������������������Ӧ��ϵ�п�ѭ��ʹ�õ�������_________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����_________������ţ���
a��I2��WI2��Ũ�����
b��W���������ٱ仯
c�������ڻ��������ܶȱ��ֲ���
d����λʱ���ڣ����������ĵ����ʵ�����⻯�����ɵ����ʵ������
��2��25��ʱ��NaHSO3��ˮ��ƽ�ⳣ����1.0��10��12mol/L������¶���H2SO3 HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��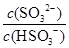 ��________�����������С�����䡱����
��________�����������С�����䡱����
��3��ֱ���ŷź�SO2���������γ����꣬Σ����������Na2SO3��Һ����SO2�Ĺ����У�pH��n��SO32������n(HSO3��)�仯��ϵ���±���
| n(SO32��): n ( HSO3��) | 91:9 | 1:1 | 1:91 |
| pH(25��) | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ǵ����к����������壬�о������仯�������������Ҫ�����塣
��1���ϳɰ���ԭ��Ϊ��N2(g)+3H2 2NH3 ��H=" -" 92.4kJ/mol
2NH3 ��H=" -" 92.4kJ/mol
�ٽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬ƽ��ʱ���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
���¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
�������H2��ת���ʣ����д�ʩ���е��� ��
a���������а�ԭ�����ٳ���ԭ����
b�����������ٳ����������
c���ı䷴Ӧ�Ĵ���
d��Һ��������������
��2����2L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g)  2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
2NO2(g) ��H��0��ϵ�У����ɷ�Ũ����ʱ��ı仯��ͼ��
����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��___________��
����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_________��
a��v(NO2)=2v(O2)
b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2)
d�������ڵ��ܶȱ��ֲ���
��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����_________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
��3������β���к���CO��NO2���ж����壬��������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����塣4CO(g)��2NO2(g) 4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
4CO2(g)��N2(g) ��H����1 200 kJ��mol��1���ڸ÷�Ӧ���¶Ȳ�ͬ(T2>T1)������������ͬʱ������ͼ����ȷ����______(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
25 ��ʱ�������Ϊ2 L���ܱ������У���̬A��B��C�����ʵ���n��ʱ��t�ı仯��ͼ1��ʾ����֪�ﵽƽ������¶ȣ�A��ת���ʽ�����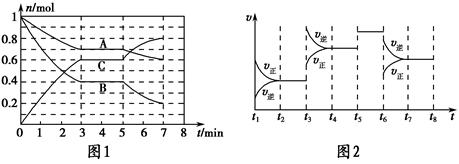
| t2��t3 | t4��t5 | t5��t6 | t7��t8 |
| K1 | K2 | K3 | K4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����̵��ͺϳɵ����ܵ�����Ҫ��ʽ���±��Ǵ����̵��ͺϳɰ��IJ���Kֵ��
| | N2+O2 2NO 2NO | N2+3H2 2NH3 2NH3 | ||
| �¶� | 25�� | 2000�� | 25�� | 400�� |
| ƽ�ⳣ��K | 3.84��10-31 | 0.1 | 5��108 | 200 |
 Cu(NH3)2AC��CO(aq)+Q(Q>0)
Cu(NH3)2AC��CO(aq)+Q(Q>0) NH4++NH2-��
NH4++NH2-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�¶�ʱ����һ���ݻ�Ϊ2 L���ܱ������У�X��Y��Z���������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��2����Ӧ��ʼ��2 min��������Z��ʾ�ķ�Ӧ����Ϊ_____��
��3����X��Y��Z��Ϊ���壬��Ӧ�ﵽƽ��ʱ��
��ѹǿ�ǿ�ʼʱ��________����
������ʱ�������������СΪԭ���� 0.5�����ﵽƽ��ʱ���������¶Ƚ�����(���������������Ƚ���)����÷�Ӧ������ӦΪ________��Ӧ(����ȡ������ȡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ��������ܱ������У����л�ѧ��ӦCO2 (g)+H2 (g) CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t / �� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I���跴Ӧ��Fe(s)+CO2(g)  FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)�� FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)
FeO(s)+H2(g)���¶�T2�½��У���֪T1>T2����c(CO2)>c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)
| ��ѧʽ | ����ƽ�ⳣ��(25��) |
| HCN | K��4.9��10��10 |
| CH3COOH | K��1.8��10��5 |
| H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com