
| A. | 氯水 | B. | NaClO溶液 | C. | 漂白粉溶液 | D. | CaCl2溶液 |
科目:高中化学 来源: 题型:实验题
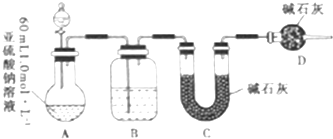
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2+2NaI=2NaBr+I2 | |
| B. | 2P+8H2O+5Br2=2H3PO4+10HBr↑ | |
| C. | 3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ | |
| D. | SO2+2H2O+Br2=H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取氯气 | B. | 实验室制取氧气 | ||
| C. | 实验室制取二氧化碳 | D. | 实验室制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属在空气中燃烧都能生成M2O(M表示碱金属) | |
| C. | 随着原子序数的增加,碱金属的熔点降低 | |
| D. | 碱金属着火应用泡沫灭火剂更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
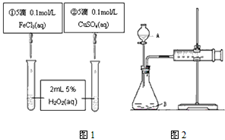 为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题
为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
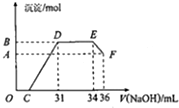 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com