
分析 (1)常见化合物中过氧化钠为淡黄色固体,铁与水蒸气反应生成四氧化三铁和氢气;
(2)氯气通入石灰乳制取漂白粉,反应生成氯化钙、次氯酸钙、水;
(3)焰色反应的操作为洗(盐酸洗)、烧、蘸、烧、洗;观察K的焰色反应需要蓝色钴玻璃滤去黄光;
(4)制备Fe(OH)2时必须隔绝空气,因易被氧气;
(5)尾气含氯气、二氧化碳,均与足量NaOH反应;
(6)涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=$\frac{70g}{63/mol}$=$\frac{10}{9}$mol,n(H2O)=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol,根据方程式结合质量守恒计算.
解答 解:(1)含上述元素的常见化合物中.呈淡黄色的是Na2O2,铁与水蒸气反应后的固休产物为Fe3O4,故答案为:Na2O2;Fe3O4;
(2)工业上将氯气通入石灰乳制取漂白粉,写山该反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)焰色反应的实验中,铂丝的清洗需要用到稀盐酸,观察K元素燃烧时的焰色需要透过蓝色钻玻璃片,故答案为:稀盐酸;蓝色钻玻璃片;
(4)实验室在制备Fe(OH)2时必须隔绝空气,否则发生氧化还原反应生成氢氧化铁,发生的现象为白色沉淀迅速变成灰绿色,最终变成红褐色沉淀,
故答案为:氢氧化亚铁易被氧化;
(5)MgO与碳粉和氯气在一定条件下反应可制备MgCl2.尾气含氯气、二氧化碳,可用足量NaOH溶液完全吸收,则生成的盐为NaCl、NaClO、Na2CO3,
故答案为:NaCl、NaClO、Na2CO3;
(6)涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=$\frac{70g}{63/mol}$=$\frac{10}{9}$mol,n(H2O)=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol,
则
4NO+3O2 +2H2O=4HNO3
4 3 2 4
n(NO) n1(O2) n(H2O) $\frac{10}{9}$mol
所以n(NO)=$\frac{10}{9}$mol,
n(H2)=n(H2O)=$\frac{5}{9}$mol+$\frac{15}{9}$mol=$\frac{20}{9}$mol,
2H2 +O2 =2H2O
2 1 2
$\frac{20}{9}$mol $\frac{10}{9}$mol
n(O2)=$\frac{10}{9}$mol+$\frac{3}{4}$×$\frac{10}{9}$mol=$\frac{17.5}{9}$mol,
2Na2O2+2CO2=2Na2CO3+O2
2 1
n(CO2) $\frac{17.5}{9}$mol
n(CO2)=2×$\frac{17.5}{9}$mol=$\frac{35}{9}$mol,
则n(NO):n(H2):n(CO2)=$\frac{10}{9}$mol:$\frac{20}{9}$mol:$\frac{35}{9}$mol=2:4:7,即体积比为2:4:7,
故答案为:2:4:7.
点评 本题考查常见金属及化合物的性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,(6)中计算为解答的难点,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
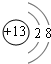 ,非金属性最强的是F.
,非金属性最强的是F.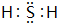 ;含有化合价为+1价的⑦的具有漂白性的一种含氧酸
;含有化合价为+1价的⑦的具有漂白性的一种含氧酸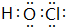 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安全气囊中原料的配比为$\frac{n(Na{N}_{3})}{n(KN{O}_{3})}$=5 | |
| B. | 若在标准状况下,产生44.8L N2,则有0.25mol KNO3参与反应 | |
| C. | 上述复分解反应发生速度很快,瞬间能产生大量气体 | |
| D. | 根据安全气囊打开时产生气体的体积(标准状况),可大致计算出气囊中原料的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸反应:2H++CO32-═CO2↑+H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++OH-═H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
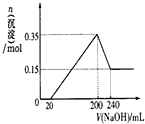 A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C
A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物已略去):A$→_{一定条件}^{+D}$B$→_{一定条件}^{+D}$C查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、K2O2、C2H2 | B. | CaC12、BaO2、MgF2 | ||
| C. | CO2、CS2、KO2 | D. | NH4Cl、NaOH、KHS04 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com