
| A. | 核内质子数 | B. | 核外电子数 | C. | 核外电子层数 | D. | 最外层电子数 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 肥皂水遇Ca2+、Mg2+ 含量较高的水有白色沉淀生成 | |
| B. | 水稻田使用NH4NO3的肥效较差 | |
| C. | 肾功能衰竭等疾病引起的血液中毒,要利用血液渗析进行治疗,渗析原理与胶体的渗析类似 | |
| D. | 在冶金厂和水泥厂常用高压电对气溶胶作用以除去大量烟尘,减小对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 甲方案中的反应涉及置换、分解、复分解三种反应类型 | |
| C. | 乙方案中加过量铁粉只能还原其中的二种阳离子 | |
| D. | 丙方案不会产生环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下,甲酸的导电性比强酸溶液的导电性弱 | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有两个电子的原子都是金属原子 | |
| B. | 最外层有五个电子的原子都是非金属原子 | |
| C. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子 | |
| D. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
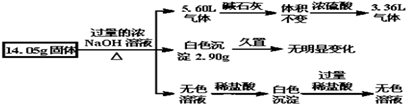
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl三种溶液的物质的量浓度关系为c(NH4HSO4)>c(NH4HCO3)>c(NH4Cl) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| C. | 室温下,向100mL0.1mol/LNaOH溶液中滴加0.1mol/LNH4HSO4溶液至溶液呈中性,溶液中各离子浓度大小关系:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)═2c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
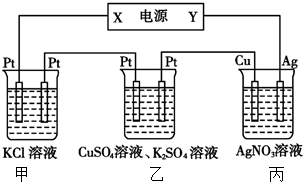
| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com