
| ||
| ||


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、①④⑦ | B、②③⑥ |
| C、①④⑤ | D、②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
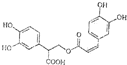
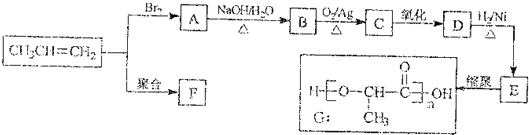
查看答案和解析>>
科目:高中化学 来源: 题型:
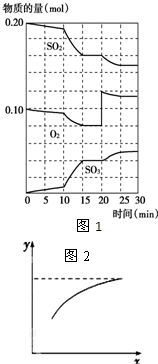 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:
| ||
| △ |
| X | y | |
| A | 再加入SO2 | O2的转化率 |
| B | 再加入SO3 | SO2的体积分数 |
| C | 压强 | 混合气体的物质的量 |
| D | 温度 | 混合气体的平均摩尔质量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | T/K | 大理石 规格 | C(HNO3)/ mol?L-1 | 实验目的 |
| ① | 25℃ | 粗颗粒 | 2.00 | (Ⅰ) 实验①和②探究HNO3浓度对该反应速率的影响;则T1为: (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | T1 | 粗颗粒 | 1.00 | |
| ③ | 35℃ | 粗颗粒 | 2.00 | |
| ④ | 25℃ | 细颗粒 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
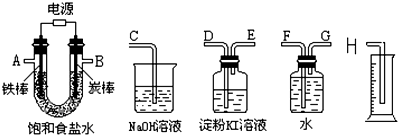
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH值 | 6.5-8.5 |
| Ca2+、Mg2+总浓度 | <0.045mol/L |
| 细菌总数 | <100个?mL-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
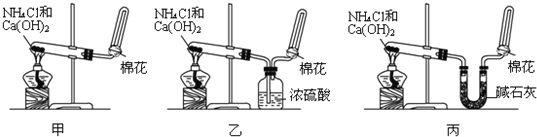
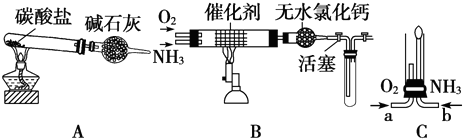
查看答案和解析>>
科目:高中化学 来源: 题型:
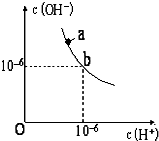 回答下列问题.
回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com