
【题目】下列离子方程式书写正确的是
A.向铁粉中加入足量稀盐酸:Fe+2H+=Fe3++H2↑
B.向FeCl3溶液中加入少量铜粉:Fe3++Cu=Fe2++Cu2+
C.Cu与稀硝酸反应:3Cu+8H++2![]() =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
D.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=![]() +2H2O
+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 加热可增强纯碱溶液去污能力:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 用惰性电极电解CuSO4溶液:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家用氮化鎵材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2下列有关说法中正确的是( )
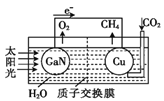
A. 该装置只有化学能转化为电能
B. 氮化镓电极是阴极
C. 导线中经过2mol的电子,氮化镓电极生成lmol O2
D. 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途,用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
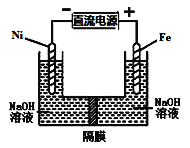
A.镍电极上的电极反应为2H2O+2e-![]() H2↑+2OH-
H2↑+2OH-
B.铁是阳极, 电极反应为Fe-2e-+OH-![]() Fe(OH)2
Fe(OH)2
C.若隔膜为阴离子交换膜, 则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高, 最终溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)的数据如图所示。
C2H5OH(g)+3H2O(g)的数据如图所示。
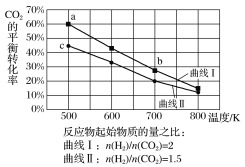
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)![]() CH3OH(l)+
CH3OH(l)+![]() O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l)![]() CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__,反应进行程度最大的是__。
(2)反应CO2+4H2![]() CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__(填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 868 | 90.1 |
Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:__(填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__(填“增大”或“减小”),其可能的原因是__。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__(列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__。(已知Co的性质与Fe相似)
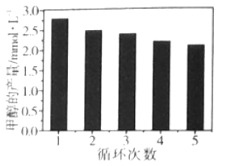
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com