
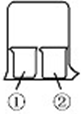
分析 (1)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨水溶液中电离出氢氧根离子和铵根离子;
(2)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀.
解答 解:(1)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨水溶液中电离出氢氧根离子和铵根离子,溶液显碱性,①中湿润的红色石蕊试纸变蓝色;
故答案为:①中湿润的红色石蕊试纸变蓝色;
(2)浓氨水具有挥发性,挥发出的氨气属于碱性气体溶于水形成一水合氨,一水合氨和氯化铝反应生成氢氧化铝沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:①中出现白色沉淀;Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查了浓氨水的性质分析,氨气溶于水形成弱碱,和氯化铝反应生成氢氧化铝沉淀,题目较简单.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | H+、Cu2+、Fe3+、SO42- | B. | Na+、Ba2+、Al3+、Cl- | ||
| C. | K+、Ag+、NH4+、NO3- | D. | Na+、K+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键,但不一定含有金属元素 | |
| B. | 分子中一定含有共价键 | |
| C. | 非极性分子中一定存在非极性键 | |
| D. | 极性分子中一定不存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H4 | D. | CH4、C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C | B. | B>C>A | C. | C>A>B | D. | B>A>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com