
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
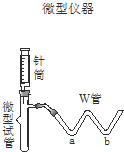 现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:
现有一瓶实验室放置已久的可能被氧化的Na2SO3固体,为了研究它的组成,请你参与同学们进行的如下探究活动:| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量固体样品于微型试管中;在W管a处滴入 | |
| 步骤2:用针筒吸入 | |
| 步骤3:拨出针筒,吸入蒸馏水洗净;再吸入 | . |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0 | B、+1 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(Cl-)>C(NH4+)>C(H+)>C(OH-) |
| B、C(C1-)=C(NH4+),且C(H+)═C(OH-) |
| C、C(NH4+)<C(Cl-)<C(H+)<C(OH-) |
| D、C(OH-)<C(NH4+)<C(H+)<C(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 | |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应的化学方程式为CO+H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com