
【题目】下列不属于空气质量日报监测的物质是( )
A.二氧化硫B.氮氧化物C.总悬浮颗粒物D.二氧化碳
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
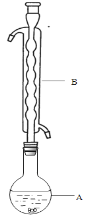
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”表示,如CH3CH=CHCH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使酸性高锰酸钾溶液褪色
D. X与足量的H2在一定条件下反应可生成饱和烃Z, Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A不能使酸性KMnO4溶液褪色,含碳量为92.3%,0.1mol A完全燃烧时生成13.44L二氧化碳(标准状况)。
(1)A的结构简式为_________。
(2)根据下列条件写出有关反应的化学方程式并指明反应类型:
①A与浓硫酸和浓硝酸的混合液反应生成B:__________,___________反应。
②在催化剂作用下A与H2反应生成C:_______________,__________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L SO3中含有的氧原子数目为0.3NA
B. 18gH218O和2H2O的混合物中,所含中子数为10NA
C. 一定条件下,2.3g的金属钠完全与氧气反应时生成3.6g产物时失去的电子数为0.1NA
D. 物质的量浓度为0.1molL﹣1的MgCl2溶液中,含有Cl﹣个数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯是海水中含量最丰富的元素,氯的单质及其化合物在生成、生活领域应用广泛。
(1)自来水厂常用液氯进行杀菌消毒。氯气溶于水发生的可逆反应为______________(用离子方程式表示)。
(2)用液氯消毒会产生微量有机氯代物,危害人体健康,可以使用二氧化氯(ClO2)代替液氯。工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯气体。已知黄铁矿中的硫元素(-1价)最终氧化成SO42-,写出制备二氧化氯的离子方程式_____________________________________。
(3)生产漂白粉工厂的主要设备是氯化塔,塔从上到下分为四层,如图为生产流程示意图。
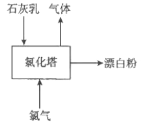
生产漂白粉反应的化学方程式为_____________________。实际生产中,将石灰乳(含有3%-6%水分的熟石灰)从塔顶喷洒而下,氯气从塔的最底层通入。这样加料的目的是_____________________________。
(4)用莫尔法可以测定溶液中Cl-的含量。莫尔法是一种沉淀滴定法,用标准AgNO3溶液滴定待测液,以K2CrO4为指示剂,滴定终点的现象是溶液中出现砖红色沉淀(Ag2CrO4)。已知平衡Cr2O72-+H2O![]() 2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
2CrO42-+2H+,该滴定过程需要控制pH范围在6.5~10.5,若pH小于6.5会使测定结果偏高。结合平衡移动原理解释偏高的原因:_______________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是
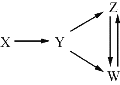
选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com