
【题目】下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( ) 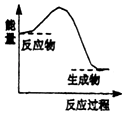
A.氢氧化钾与硫酸的反应
B.金属镁与盐酸的反应
C.高温条件下碳粉与二氧化碳的反应
D.Ba(OH)28H2O晶体与NH4Cl固体的反应
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是
A. 浓硝酸和稀硝酸都具有氧化性
B. 铜与硝酸的反应属于置换反应
C. 浓硝酸在常温下见光或受热会分解
D. 常温下可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验: 【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 .
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= .
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究. 
①该小组同学提出的假设是 .
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2 通入下列溶液中:( )
①BaCl2溶液 ②澄清的石灰水 ③饱和Na2CO3溶液 ④K2SiO3溶液;可能变浑浊的是:
A. ①② B. ①②③ C. ①②③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,71 g Cl2含有2NA个Cl原子
B.把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol·L-1
C.物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+
D.常温常压下,11.2 L N2中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离的方法不正确的是 ( )
A. 用酒精萃取碘水中的碘
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用淘洗的方法从沙里淘金
D. 用过滤的方法除去食盐中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
不正确的操作顺序是
A.③②①⑤④ B.③①②⑤④ C.②③①⑤④ D.②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式____________________________________。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式_____________________________。
(3)断裂1 mol化学键所需的能量如表所示:
共价键 | H—N | H—O | N≡N | O==O |
断裂1 mol化学键所需能量/kJ | 393 | 463 | 941 | 496 |
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com