
| A、HCl气体溶于水. |
| B、碘升华 |
| C、葡萄糖溶于水 |
| D、溴蒸气被活性炭吸附 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 15 | 25 |
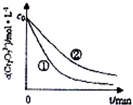
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al是还原剂,TiC是氧化产物 |
| B、TiO2是氧化剂,TiC是还原产物 |
| C、反应中氧化剂与还原剂的物质的量之比是1:1 |
| D、生成1molTiC时转移4mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铜做电极电CuSO4解溶液:2Cu2++2H2O
| ||||
| B、在NH4Fe(SO4)2溶液中,滴加少量Ba(OH)2溶液:2NH4++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ | ||||
| C、在Na2CO3溶液中逐滴滴入稀盐酸溶液,反应开始阶段:CO32-+H+═HCO3- | ||||
| D、在Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液呈电中性,胶体带电 |
| B、用一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| C、溶液中的分散质粒子能透过滤纸,胶体中分散质粒子不能透过滤纸 |
| D、将FeCl3溶液滴加到沸水中,长时间加热煮沸就可制得Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
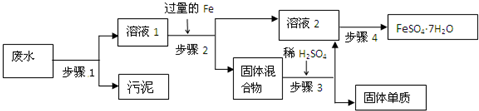
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com