
| 8-2x |
| 8-2x+4-x+2x |
| 4 |
| 7 |
| ||
| 5min |
| 8-2x |
| 8-2x+4-x+2x |
| 4 |
| 7 |
| 4 |
| 7 |
| 48 |
| 7 |
| 48 |
| 7 |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A、200 | B、230 |
| C、260 | D、404 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、58.5g氯化钠固体中含有NA个氯化钠分子 |
| B、5.6 g铁粉与酸反应失去的电子数一定为0.2NA |
| C、6.0g金刚石中含有的共价键数为NA |
| D、标况下,11.2LSO3所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
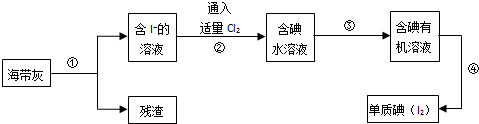

查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )| A、a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B、a点对应的Ksp不等于c点对应的Ksp |
| C、b点将有沉淀生成 |
| D、向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C、在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数 |
| D、沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com