
����Ŀ�����״�����
��.ʹ����ȷ�Ļ�ѧ�������
��1��д���������ʵĵ���ʽ
����_______ �������� _________ ���Ȼ�̼________
��2��д���������ʵĽṹʽ
������̼ ________�������� _________ ������________
��ѧ���⣩��ȷ��д������ĵ���ʽ��Ҫע���������_____________
����ȷ�Ƚ����и����Ӧ��ϵ
��1����֪������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����������Ԫ�أ�
��ԭ�������ɴ�С��˳��Ϊ��___________
��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��___________
�����Ӱ뾶�ɴ�С��˳��Ϊ��___________
��2���Ƚ��������뾶��С���á������������
��F��________Cl�� ��Fe2��________Fe3�� ��O2��_________Mg2��
��ѧ���⣩���Ӱ뾶��С�ȽϷ��������㼴�ɣ�___________
���𰸡� ![]()
![]()
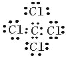 O=C=O H-O-O-H H-O-Cl ���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ� A>B>D>C B>A>C>D C3��>D��> B��> A2�� �� �� �� ���Ӳ���Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
O=C=O H-O-O-H H-O-Cl ���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ� A>B>D>C B>A>C>D C3��>D��> B��> A2�� �� �� �� ���Ӳ���Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
�������������������.��1�����������д��ڵ�����������ԭ�������Ϊ8���ӣ���������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����ӣ���2��������̼�д�������̼��˫����˫��ˮΪ���ۻ���������д��������������һ��O-O��������������д���H-O����O-Cl������1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ���� ����2�����Ӳ���Խ��뾶Խ���Ӳ���������������ͬ��������Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС��
����2�����Ӳ���Խ��뾶Խ���Ӳ���������������ͬ��������Խ��뾶Խ���Ӳ�����ͬ��������Խ��뾶ԽС��
��������.��1�����������д��ڵ�����������ԭ�������Ϊ8���ӣ�N2�ĵ���ʽΪ����![]() ����������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ��������Ƶĵ���ʽΪ
����������Ϊ���ӻ��������ʽ����Ҫ�����������������ɣ��������Ƶĵ���ʽΪ![]() �����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����������Ȼ�̼�ĵ���ʽΪ
�����Ȼ�̼Ϊ���ۻ����̼ԭ�ӡ���ԭ������㶼��8�����������Ȼ�̼�ĵ���ʽΪ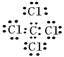 ����2��������̼�д�������̼��˫�����ṹʽΪO=C=O��˫��ˮΪ���ۻ���������д��������������һ��O-O�����ṹʽΪH-O-O-H������������д���H-O����O-Cl����������Ľṹʽ��H-O-Cl����ȷ��д������ĵ���ʽ��Ҫע���������:���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ���1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ����
����2��������̼�д�������̼��˫�����ṹʽΪO=C=O��˫��ˮΪ���ۻ���������д��������������һ��O-O�����ṹʽΪH-O-O-H������������д���H-O����O-Cl����������Ľṹʽ��H-O-Cl����ȷ��д������ĵ���ʽ��Ҫע���������:���ӻ�����ĵ���ʽ����дע�������ӵĵ���ʽΪ�����ӱ���������������Ҫ�����������еĵ��Ӳ������ţ����ϵ�ɡ����ۻ�����ĵ���ʽ������ɣ��������ţ���1��������Ԫ�ص���������A2����B����C3����D��������ͬ�ĵ��Ӳ�ṹ����A��B��C��D�����ڱ��е�λ���� ��������ԭ�������ɴ�С��˳��Ϊ��A>B>D>C����B��A���Ӳ�������C��D�����뾶B��A����C��D��ͬ����Ԫ�ش����Ұ뾶��С��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��B>A>C>D���۵��Ӳ�����ͬ��������Խ��뾶ԽС�����Ӱ뾶�ɴ�С��˳��Ϊ��C3��>D��> B��> A2������2���ٵ��Ӳ���Խ��뾶Խ��������F��<Cl���������Ӳ���������������ͬ��������Խ��뾶Խ������Fe2��>Fe3�����۵��Ӳ�����ͬ��������Խ��뾶ԽС������O2��>Mg2�������Ӱ뾶��С�ȽϷ��������Ӳ���Խ��뾶Խ�������Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��
��������ԭ�������ɴ�С��˳��Ϊ��A>B>D>C����B��A���Ӳ�������C��D�����뾶B��A����C��D��ͬ����Ԫ�ش����Ұ뾶��С��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��B>A>C>D���۵��Ӳ�����ͬ��������Խ��뾶ԽС�����Ӱ뾶�ɴ�С��˳��Ϊ��C3��>D��> B��> A2������2���ٵ��Ӳ���Խ��뾶Խ��������F��<Cl���������Ӳ���������������ͬ��������Խ��뾶Խ������Fe2��>Fe3�����۵��Ӳ�����ͬ��������Խ��뾶ԽС������O2��>Mg2�������Ӱ뾶��С�ȽϷ��������Ӳ���Խ��뾶Խ�������Ӳ�����ͬ��������Խ��뾶ԽС�����Ӳ���������������ͬ��������Խ��뾶Խ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��£���H2��I2��1mol����̬��������1L���ܱ������У�������Ӧ��H2��g��+I2��g��2HI��g����H��0��5min��ﵽƽ��״̬�����c��H2��=0.9molL��1 �� �����н����У����ܳ������ǣ� ��
A.ƽ��ʱH2��I2��ת�������
B.�ӷ�Ӧ��ʼ��ƽ��Ĺ����У�v��HI��=0.04molL��1min��1
C.���������������������г�������H2 �� I2��ת�������
D.���������¶���ߣ���ƽ�ⳣ��Kһ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɢϵ���ʵ������ǣ� ��
A. �Ƿ����������B. �ܷ������������
C. �Ƿ��һ���ȶ�����D. ��ɢ������ֱ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�У��������ӿ��ܴ���������ǣ� ��
A.��ˮ�������c��H+��=10��13 mol?L��1����Һ�У�Al3+��K+��NO ![]() ��SO
��SO ![]()
B.ǿ������Һ�У�Cu2+��ClO����Cl����Ba2+
C.0.1 mol?L��1 ��NaHCO3��Һ�У�K+��Al3+��Fe3+��NO ![]()
D.pH=7����Һ�У�K+��Fe3+��Cl����NO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ���ǣ� ��
A.�ö��Ե缫��ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ��2Cl����2e���TCl2��
B.��Mg��Al��NaOH��Һ���ԭ��أ��为����ӦʽΪ��Al+3e��+4OH���TAlO2��+2H2O
C.��ͭ����ʱ�����Դ�����������Ǵ�ͭ���缫��ӦʽΪ��Cu��2e���TCu2+
D.��Al��Cu��Ũ�������ԭ�������Դ����ʯī�缫�������������Һ��������2 mol Agʱ������ͭ�缫32 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʣ�����������ʡ������˳�����е��ǣ� ��
A. ���Һ̬�������B. ��ʯ�ҡ����ס���ʯ��
C. �ɱ��������Ȼ���D. ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪������R2����ԭ�Ӻ�����n�����ӣ�Rԭ�ӵ�������Ϊm����� g Rԭ����ȫת��ΪR2��ʱ�����е��ӵ����ʵ�����___________
��2��ijԪ�ص�һ��ͬλ��X��ԭ��������ΪA����N�����ӣ�����1Hԭ�ӳ�HmX���ӣ���a g HmX���������ӵ����ʵ�����___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������з�����ӦN2+3H22NH3 �� �ﵽƽ���ֻ�ı�ijһ������ʱ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��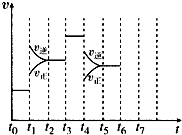
�ش��������⣺
��1������ƽ��״̬��ʱ���������ѡ���
A.t0��t1
B.t1��t2
C.t2��t3
D.t3��t4
E.t4��t5
F.t5��t6
��2��t1��t3��t4ʱ�̷ֱ�ı��һ�������ǣ���ѡ���A������ѹǿ B����Сѹǿ C�������¶�
D�������¶� E���Ӵ��� F�����뵪��
t1ʱ����t3ʱ����
��3�����ݣ�2���еĽ��ۣ�����ʱ����У����İٷֺ�����ߵ�������ѡ���
A.t0��t1
B.t2��t3
C.t3��t4
D.t5��t6
��4��һ�������£��ϳɰ���Ӧ�ﵽƽ��ʱ����û�������а������������Ϊ20%����Ӧ���뷴Ӧǰ�Ļ���������֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com