
| A. |  用如图装置由氯化镁溶液制取无水氯化镁晶体 | |
| B. | 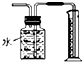 用如图所示装置测量Cu与浓硝酸反应生成气体的体积 | |
| C. | 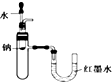 用如图所示装置验证Na和水反应的热效应 | |
| D. | 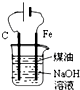 用如图装置制备Fe(OH)2并能较长时间观察其颜色 |
分析 A.氯化镁易水解;
B.二氧化氮易与水反应,且易溶于水;
C.钠与水反应放热,U型管中左侧降低;
D.铁应为阳极.
解答 解:A.氯化镁易水解,应在氯化氢的氛围中加热,否则生成氢氧化镁,故A错误;
B.二氧化氮易与水反应,且易溶于水,不能用排水法测量体积,故B错误;
C.钠与水反应放热,U型管中左侧降低,则装置可验证Na和水反应的热效应,故C正确;
D.制备氢氧化亚铁,应首先生成亚铁离子,铁应为阳极,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及物质的分离、制备等基本实验,侧重于学生的分析能力、评价能力和实验能力的考查,为高考常见题型,注意把握实验的严密性和相关物质的性质,难度不大.


科目:高中化学 来源: 题型:推断题
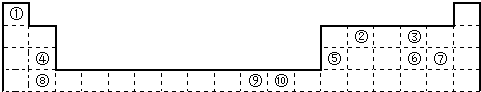
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | MnO2可加快H2O2的分解速率是因为降低了该反应的活化能 | |
| C. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 化合物乙中只有共价键 | |
| B. | 甲可与Z和X形成的某种化合物反应生成强酸 | |
| C. | W的氧化物只能与碱反应,不能与任何酸反应 | |
| D. | X分别与Y、Z、G、W形成的气态化合物中,稳定性最好的是XG |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | 2 +Br2$\stackrel{FeBr_{3}}{→}$2 +Br2$\stackrel{FeBr_{3}}{→}$2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com