
| A.1L 0.1 mol·L—1的CH3COONa溶液中CH3COO—的总数是0.1NA |
| B.常温常压下,1.6g O2和O3混合气体中质子总数为0.8 NA |
| C.一定条件下,2mol SO2和 1mol O2发生反应,转移的电子总数一定是4NA |
| D.1L 0.1mol·L—1的葡萄糖溶液中分子总数为0.1 NA |
科目:高中化学 来源:不详 题型:单选题
A.2mol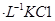 溶液与lmol 溶液与lmol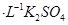 溶液混合后, 溶液混合后,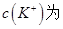 2mol 2mol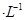 |
| B.120gNaC1溶液中溶有20gNaCl,该温度下NaC1的溶解度为20g |
C.22.4LHCl气体溶于水制成1L溶液,该溶液的物质的量浓度为lmol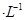 |
D.把5g胆矾(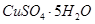 )溶于45g水中,所得溶液溶质的质量分数为10% )溶于45g水中,所得溶液溶质的质量分数为10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 气体 | 烧瓶和气体的总质量(g) |
| A | 48.4082 |
| B | 48.4082 |
| C | 48.4082 |
| D | 48.4342 |
| E | 48.8762 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力 |
| B.上述反应中SiC既是氧化产物又是还原产物 |
| C.SiCl4是由极性键构成的非极性分子 |
| D.CCl4分子、SiCl4分子、SiC晶体中各原子都达到了8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.失电子越多,该物质的还原性就越强 |
| B.含有最高价元素的化合物一定具有强氧化性 |
| C.氧化剂氧化其他物质时,本身被还原 |
| D.某元素由化合态变成游离态一定被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
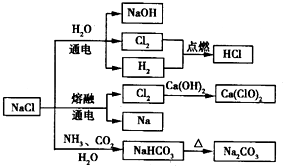
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com