
【题目】已知A是由四种元素组成的固态化合物,K、E、H、L为常见单质,其中L能使带火星的木条复燃,D、G、I是三种常见的化合物,J为化学工业中常用的强酸,其产量可以衡量一个国家化工业水平,X为蓝色絮状沉淀化合物.经测定D是由两种非金属元素组成的化合物,能使澄清的石灰水变浑浊.它们在一定条件下的相互转化关系如如图1所示(某些反应物、生成物和反应条件已略去).
(1)在D、G、I三种化合物中,一定含有L、H两种元素的化合物是(用字母表达).
(2)化合物D结构式是 .
(3)写出A分解的化学反应方程式为: .
(4)写出M与酸性高锰酸钾反应的离子方程式并标出电子转移方向和数目: .
在标准状况下,用惰性电极电解体积为2L的溶液F,当时间达到t时断开电源,发现只需补充22.2g固体A即可使电解液恢复原浓度与体积,则原溶液F的浓度是 molL﹣1;假设电解过程中,控制电流与电压保持稳定,请在图2中画出阴阳两极产生的气体体积与时间的关系图 .
【答案】
(1)D、G
(2)O=C=O
(3)Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2 ↑
2CuO+H2O+CO2 ↑
(4) ;0.1;
;0.1;
【解析】解:L能使带火星的木条复燃,则L为O2 , D、G、I是三种常见的化合物,J为化学工业中常用的强酸,其产量可以衡量一个国家化工业水平,则J为H2SO4 , X为蓝色絮状沉淀化合物,则F与氢氧化钠反应得到,所以X为Cu(OH)2 , F中含有铜离子,M与高锰酸钾反应得J,且M由浓硫酸与金属K反应得到,所以K为Cu,M为SO2 , 根据转化关系,F和C混合应为硫酸铜溶液,所以L为O2 , C应为H2O,F为CuSO4 , 经测定D是由两种非金属元素组成的化合物,能使澄清的石灰水变浑浊,则D为CO2 , E为Mg,二氧化碳与镁反应生成 氧化镁与碳,所以I为MgO,H为C,碳与二氧化碳反应生成 G为CO,根据B与J反应生成硫酸铜,则B为CuO,根据B、D、C的化学式可知,A为Cu2(OH)2CO3 , (1)根据上面的分析可知,D为CO2 , G为CO,L为O2 , 所以在D、G、I三种化合物中,一定含有L、H两种元素的化合物是D、G,
所以答案是:D、G;(2)D为CO2 , D结构式是O=C=O,
所以答案是:O=C=O;(3)A为Cu2(OH)2CO3 , A分解的化学反应方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2 ↑,
2CuO+H2O+CO2 ↑,
所以答案是:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2 ↑;(4)M为SO2 , M与酸性高锰酸钾反应的离子方程式并标出电子转移方向和数目为
2CuO+H2O+CO2 ↑;(4)M为SO2 , M与酸性高锰酸钾反应的离子方程式并标出电子转移方向和数目为  ,补充22.2gA即Cu2(OH)2CO3 , 其物质的量为0.1mol,即可使电解液恢复原浓度与体积,根据铜元素守恒可知,n[CuSO4]=0.2mol,所以则原溶液CuSO4的浓度是
,补充22.2gA即Cu2(OH)2CO3 , 其物质的量为0.1mol,即可使电解液恢复原浓度与体积,根据铜元素守恒可知,n[CuSO4]=0.2mol,所以则原溶液CuSO4的浓度是 ![]() =0.1molL﹣1;假设电解过程中,控制电流与电压保持稳定,请在图2中画出阴阳两极产生的气体体积与时间的关系图.加入0.1molCu2(OH)2CO3即相当于加0.1molCu(OH)2和0.1molCuO,能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒得n(O2)=n[Cu(OH)2]+
=0.1molL﹣1;假设电解过程中,控制电流与电压保持稳定,请在图2中画出阴阳两极产生的气体体积与时间的关系图.加入0.1molCu2(OH)2CO3即相当于加0.1molCu(OH)2和0.1molCuO,能使溶液恢复原状,阳极上氢氧根离子放电生成氧气,根据氧原子守恒得n(O2)=n[Cu(OH)2]+ ![]() CuO=0.15mol,则氧气体积=0.15mol×22.4L/mol=3.36L,电解池的阴极先是铜离子放电,铜离子总物质的量为0.2mol,此时阳极产生的氧气的物质的量为0.1mol,即体积为2.24L,铜离子放电结束后,阴极上是氢离子放电,根据氢元素守恒,n(H2)=n[Cu(OH)2]=0.1mol,产生的氢气的体积为2.24L,所以画出图为
CuO=0.15mol,则氧气体积=0.15mol×22.4L/mol=3.36L,电解池的阴极先是铜离子放电,铜离子总物质的量为0.2mol,此时阳极产生的氧气的物质的量为0.1mol,即体积为2.24L,铜离子放电结束后,阴极上是氢离子放电,根据氢元素守恒,n(H2)=n[Cu(OH)2]=0.1mol,产生的氢气的体积为2.24L,所以画出图为 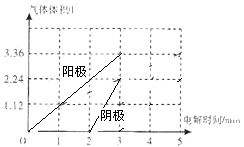 ,
,
所以答案是:  ;0.1;
;0.1;  .
.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列关于1mol·L-1的Na2SO4溶液说法正确的是( )
A. 溶液中含有1molNa2SO4 B. 1mol Na2SO4溶于1L水中制得
C. 1L溶液中含有1 mol Na2SO4 D. Na+的浓度是1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在.已知在溶液中IO3-可以和I-发生反应: IO3-+5I-+6H+===3I2+3H2O,根据此反应,可用试纸和生活中常见的一些物质进行实验,证明在食盐中存在IO3-.进行上述实验时必须使用的物质是( )
①自来水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒
A.①③
B.③⑥
C.②④⑥
D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm 之间 B. 能透过半透膜
C. 加入浓氢氧化钠溶液都产生红褐色沉淀 D. 颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知破坏1molH-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1 molHCl总的过程需要( )
A. 放热185kJB. 吸热185kJC. 放热92.5 kJD. 吸热92.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O=2Fe+6NaCl+6H3BO3+21H2↑.下列说法正确的是( )
A.该反应中氧化剂只有FeCl3
B.NaBH4的电子式为 ![]()
C.NaBH4与稀硫酸不发生反应
D.该反应中每生成1 mol Fe,转移的电子数为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.
请回答下列问题:
(1)维生素A中的含有官能团种类有 , (官能团名称),它使溴水褪色(填“能”或“否”),
(2)维生素A1的结构简式如图,若1mol维生素A1分子最多可跟molH2发生加成反应. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示. 
回答下列问题:
(1)原NaOH溶液的物质的量浓度为mol/L;
(2)题中通入CO2后所得溶液的溶质成分为 , 若将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com