
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应自发进行的判断依据是△H-T△S<0;
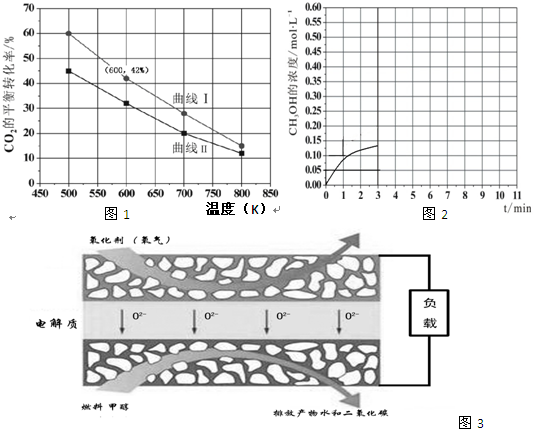
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.结合三行式进行计算,化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
b.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
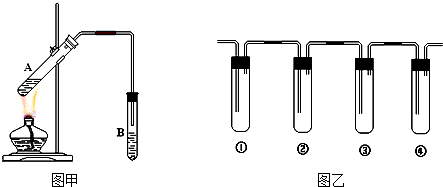
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子数,结合法拉第常数为9.65×104C•mol-1计算电量.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ•mol-1;较低温;
(2)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比较B相当于增大二氧化碳的量,转化率小于A,所以曲线 I代表A的投料,
故答案为:A.
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.5 1 0 0
变化浓度:0.3 0.9 0.3 0.3
平衡浓度:0.2 0.1 0.3 0.3
a.该温度下,反应I的平衡常数K=$\frac{0.3×0.3}{0.2×0.{1}^{3}}$=450,
500K时,若在此容器中开始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,浓度分别为0.1mol/L,0.3mol/L,0.2mol/L,$\frac{x}{3}$mol/L
若使反应在开始时正向进行,浓度商Qc=$\frac{0.2×\frac{x}{3}}{0.3×0.{1}^{3}}$<K=450
x=2.025
则x应满足的条件是0<x<2.025
故答案为:450,0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为,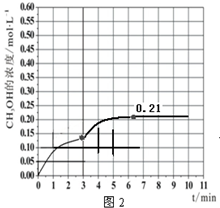
故答案为: ;
;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O,
故答案为:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物质的量=$\frac{16g}{32g/mol}$=0.5mol,发生反应时电子转移0.5mol×6=3mol,则理论上提供的电量最多为3mol×9.65×104C•mol-1=2.895×105 C,
故答案为:2.895×105 C.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 25℃时,PH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 室温下,0.100 mol•L-1碳酸钠溶液中,CO32-数目小于0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- | |
| B. | 明矾水解的离子方程式:Al3++3 H2O?Al(OH)3+3H+ | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-═H2O+CO32- | |
| D. | 表示氢气燃烧的热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
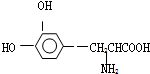 这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )
这种药物的研制是基于获得2000年诺贝尔生理学或医学奖和获得2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述不正确的是( )| A. | 该有机物可看作氨基酸,也可看作是酚类物质 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 分子中至少有7个碳原子在同一平面内 | |
| D. | 既能与溴水发生取代反应,又能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是中和反应的逆反应 | |
| B. | 水的电离平衡被破坏 | |
| C. | 盐类水解破坏盐的电离平衡 | |
| D. | 配制硫酸铜溶液时,加入适量的硫酸,是为了抑制硫酸铜的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g乙醇与足量的金属钠反应,可以放出0.25mol 氢气 | |
| B. | 1mol 乙醇充分燃烧生成2mol CO2 和3mol H2O,消耗3mol O2 | |
| C. | 乙醇的沸点高于乙烷 | |
| D. | 1mol 乙醇氧化后生成1mol 乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com