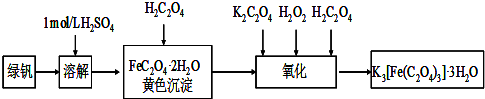
绿矾(FeSO
4?7H
2O)是治疗缺铁性贫血药品的重要成分.孔雀石主要含Cu
2(OH)
2CO
3,还含有Fe、Si的化合物(含硅物质不溶于酸).某工厂设计以孔雀石、废铁屑、稀硫酸等为原料制备CuSO
4?5H
2O与FeSO
4?7H
2O,流程如图所示.请回答下列问题:
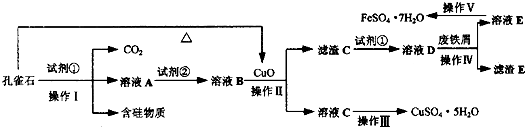
(1)试剂①为
稀硫酸
稀硫酸
,孔雀石与试剂①反应的主要化学方程式为
Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
.
(2)溶液A中的金属阳离子除Cu
2+外,还可能含有Fe
2+和Fe
3+中的一种或两种,检验Fe
3+存在的最佳试剂为
KSCN溶液
KSCN溶液
.为了确定溶液A中是否含有Fe
2+并测定其浓度大小,设计以下实验方案:
①配制溶液.取A溶液10mL,配成250mL,配制溶液所需的仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是
250ml容量瓶
250ml容量瓶
.
②滴定检测.取25mL所配溶液于锥形瓶中,滴加a mol?L
-1酸性KMnO
4溶液V ml时,溶液恰好变为淡紫色且半分钟内不变色.
③分析计算.A溶液中是否含有Fe
2+?
含有
含有
(填“含有”或“不含有”,若填“不含有”,则下列空白不用填写),则A溶液中C(Fe
2+)为
5aVmol/L
5aVmol/L
.
(3)从以下试剂中选择:试剂②为
C
C
(填序号),选择原因是
既能将Fe2+氧化而又不引入新杂质
既能将Fe2+氧化而又不引入新杂质
.
a.KMnO
4b.(NH
4)
2S
c.H
2O
2d.Cl
2(4)已知滤渣C为Fe(OH)
3,试解释向溶液B中加入CuO的作用:
除去多余的稀硫酸,调节溶液的PH
除去多余的稀硫酸,调节溶液的PH
.
(5)由溶液C获得CuSO
4?5H
2O,需要经过加热蒸发、
冷却结晶
冷却结晶
、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是
引流
引流
.
(6)操作V得到的绿矾晶体用少量液体洗涤,该液体可以是
C
C
(填序号).
A.冰水
B.蒸馏水
C.80%酒精溶液
D.CCl
4.




 同步练习强化拓展系列答案
同步练习强化拓展系列答案