
| A. | 把氢氧化钠固体放在滤纸上称量 | |
| B. | 制取氯气时,将二氧化锰与浓盐酸加强热,用向下排气法收集氯气 | |
| C. | 配制0.1mol/L H2SO4溶液时,将量取的浓H2SO4放入容量瓶中稀释 | |
| D. | 做焰色反应时,每次实验前一定要用稀盐酸洗净铂丝,并在火焰上灼烧到没有颜色 |
分析 A.NaOH易潮解,具有腐蚀性;
B.氯气的密度比空气密度大;
C.不能在容量瓶中稀释;
D.焰色反应之前需要稀盐酸洗涤铂丝,并灼烧.
解答 解:A.NaOH易潮解,具有腐蚀性,应在小烧杯中称量,故A错误;
B.氯气的密度比空气密度大,则制取氯气时,将二氧化锰与浓盐酸加强热,用向上排气法收集氯气,故B错误;
C.不能在容量瓶中稀释,应在烧杯中稀释,故C错误;
D.焰色反应之前需要稀盐酸洗涤铂丝,并灼烧,灼烧到没有颜色,操作合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、气体的制备、焰色反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的CO、N2含有的分子数均为NA | |
| B. | 0.5 mol/L的MgCl2溶液中Cl-离子的物质的量为NA | |
| C. | 常温常压时,4.48 L CH4气体中含有的原子数大于NA | |
| D. | 12克13C含有的碳原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强时,正、逆反应速率都减小,平衡向正反应方向移动 | |
| B. | 降低温度时,正、逆反应速率都减小,平衡向逆反应方向移动 | |
| C. | 恒容时,充入稀有气体,Y的转化率变大 | |
| D. | 此反应为熵减反应,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能用丁达尔效应可以区分Fe(OH)3胶体和FeCl3溶液 | |
| B. | 配制100g20%的硝酸钾溶液,不需要用到容量瓶 | |
| C. | 可以用酒精萃取的方法将溴从溴水中提取出来 | |
| D. | 焰色反应实验前,应先用稀硫酸洗净铂丝,再在酒精灯上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
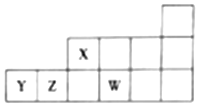
| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | X、Z、W形成的简单氢化物中X的氢化物沸点最高 | |
| D. | W与Y元素形成的化合物在水溶液中能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com