
碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g) 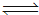 CO(g) +H2(g) ΔH= +131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH= +131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)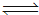 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则CO(g)+H2O(g)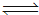 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
 (4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
 其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
 该温度下此反应的平衡常数K=___________
该温度下此反应的平衡常数K=___________
 其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
【知识点】化学平衡的影响因素、有关反应热的计算、化学电源新型电池、化学平衡的计算
【答案解析】(1)AD (2分) (2)-41.2KJ/mol(2分)
CH3OH+H2O-6e-=CO2↑+6H+ (3分) (4)< (2分) ‚0.36 (2分) ƒ不变 (3分)
解析:(1)达到平衡后,体积不变时,能提高H2的产率,应使平衡向正反应方向移动,反应是吸热反应;A.反应是吸热反应,升高温度平衡正向进行,反应速率增大,有利于提高H2的产率,故A符合; B.增加碳的用量,固体不改变化学平衡,H2的产率不变,故B不符合; C.加入催化剂改变化学反应速率,不改变化学平衡,H2的产率不变,故C不符合; D.用CO吸收剂除去CO,平衡正向进行,H2的产率增大,故D符合;
故答案为:AD;
①C(s)+CO2(g)⇌2CO(g)△H=+172.5kJ•mol-1,
②C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1,
依据热化学方程式和盖斯定律②-①得到,CO(g)+H2O(g)⇌CO2(g)+H2(g),△H=-41.2kJ•mol-1;
甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O-6e-=CO2+6H+;
 反应是放热的,其他条件不变,降低温度,平衡正向移动,反应达到新平衡前v(逆)<v(正);
反应是放热的,其他条件不变,降低温度,平衡正向移动,反应达到新平衡前v(逆)<v(正);
 依据平衡三段式列式计算
依据平衡三段式列式计算
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始(mol/L) 0.08 0.08 0 0
转化(mol/L) 0.03 0.03 0.03 0.03
平衡(mol/L) 0.05 0.05 0.03 0.03
K=C(H2)C(CO2)/C(CO)C(H2O)=0.36
 其他条件不变,再充入0.1mol CO和0.1mol H2O(g),等体反应与先前反应式等效的,所以平衡时CO的体积分数不变。
其他条件不变,再充入0.1mol CO和0.1mol H2O(g),等体反应与先前反应式等效的,所以平衡时CO的体积分数不变。
【思路点拨】本题考查较为综合,涉及原电池、电解质以及化学平衡问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握化学平衡常数的应用以及平衡移动的影响因素,难度中等。


科目:高中化学 来源: 题型:
“水是生命的源泉”.下面对水化学式(H2O)意义的理解,错误的是( )
A.水是一种氧化物 B.水是由氢、氧两种元素组成的
C.水分子中含有氢、氧两种原子 D.水分子中含有两个氢原子、一个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
新药帕拉米韦注射液可用于治疗H7N9禽流感,其说明书中部分内容如下图。
(1)帕拉米韦由 种元素组成,其中氢、氮的原子个数比为 。
(2)帕拉米韦属于_____________(填“有机物”或“无机物”)。
(3)成人禽流感患者,每天应注射帕拉米韦________支。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.按系统命名法,有机物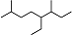 可命名为3,7-二甲基-4-乙基辛烷
可命名为3,7-二甲基-4-乙基辛烷
B.环己醇分子中所有的原子可能共平面
C.谷氨酸分子(α- 氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构)
D.在一定条件下,1.0 mol的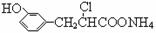 最多能与含3.0 mol NaOH的溶液完全反应
最多能与含3.0 mol NaOH的溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置或操作正确的是 ( )
|
|
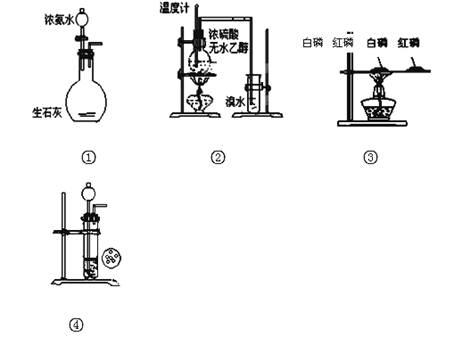
A.实验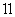 制取氨气
制取氨气
B.实验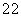 溴水褪色证明了乙烯可以与溴发生加成反应
溴水褪色证明了乙烯可以与溴发生加成反应
C.实验 比较红磷和白磷的着火点
比较红磷和白磷的着火点
D.实验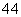 用CaC2和饱和食盐水反应制取C2H2
用CaC2和饱和食盐水反应制取C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
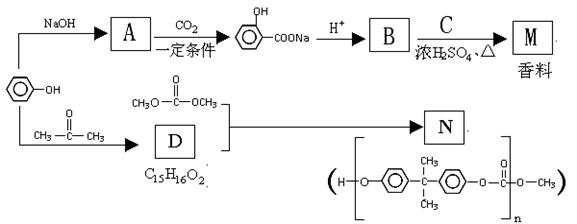
⑴苯酚的俗名是______________。B的官能团名称_____________ 。
⑵已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。
B与C反应的化学方程式是 。
⑶生成N的反应方程式 。
⑷以苯酚为基础原料也可以合成有机物E。已知E的相对分子质量为122,其中氧元素的质
量分数为26.23%,E完全燃烧只生成CO2和H2O。则E的分子式是 。
⑸ 已知E具有如下结构特征:
①属于芳香族化合物,不能发生水解反应,但能产生银镜现象;
② E的核磁共振氢谱显示其分子中含有4种不同的氢原子。
E的结构简式是_____________________________。
 ⑹物质F如右图,则符合下列条件F的同分异构体有__ ___ 种。
⑹物质F如右图,则符合下列条件F的同分异构体有__ ___ 种。
①能发生银镜反应 ②能与NaHCO3溶液反应
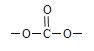 ③分子中有苯环,无 结构
③分子中有苯环,无 结构
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应3H2 + N2 
 2NH3 中,经一段时间后,氨的浓度增加了0.6mol / L,在此时间内用H2表示的平均反应速率为0.45mol / (L.s),则反应所经过的时间为
2NH3 中,经一段时间后,氨的浓度增加了0.6mol / L,在此时间内用H2表示的平均反应速率为0.45mol / (L.s),则反应所经过的时间为
A、0.44s B、1s C、0.33s D、2s
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)在(1)中若充入的是2.5 mol CO(g)和4 mol H2 (g),达到平衡后混合气体的平均相对分子质量为 ;若要求达到平衡后混合气体的平均相对分子质量始终大于该值,则充入的CO、H2混合气体的总质量m和总物质的量n必须满足的关系为
查看答案和解析>>
科目:高中化学 来源: 题型:
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入正催化剂
A.①②③ B.②③⑤ C.②⑤ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com