
下列实验操作正确且能达到预期目的的是( )
| 实验目的 | 操作 | |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2===CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 比较碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO2水溶液的pH |
A.①④⑤ B.②③⑤
C.①⑤⑥ D.①②③④⑤⑥
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
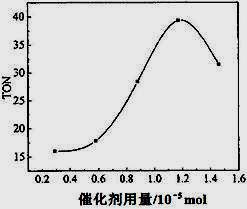 碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
(1)已知25℃时,甲醇和DMC的标准燃烧热分别为△H1和△H2,则上述反应在25℃时的焓变△H3=___________。
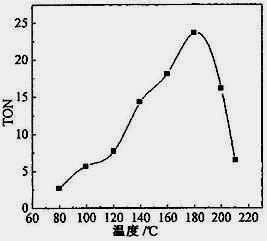
(2)根据反应温度对TON的影响图(下左图)判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是________________________________。
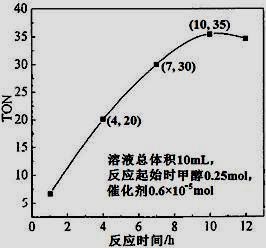
(3)根据反应时间对TON的影响图(上右图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量对TON的影响图(左图),判断下列说法正确的是___ __。
a. 由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b. 在反应体系中添加合适的脱水剂,将提高该反应的TON
c. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学键的说法中错误的是( )
A.氯化钠熔化或氯化氢溶于水时都要破坏化学键
B.离子化合物中可能含有共价键,共价化合物中一定不含有离子键
C.氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
D.碘晶体升华和冰融化时都未涉及化学键的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(1) 在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同),该原子结构示意图为_________。元素⑩名称为 在周期表中的位置 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式 ,该化合物是由 __________________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____________________。
(6)元素③的氢化物的结构式为_____ ___;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是( )

A.用图甲装置进行稀硝酸与铜的反应制取并收集NO
B.用图乙装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图丙装置检验电流的方向
D.用图丁装置制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
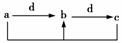
| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | CH3CH2OH | CH3CHO | CH3COOH | O2 |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2﹣、MnO4﹣、CO32﹣、SO42﹣中的若干种离子组成,取溶液进行如图实验:
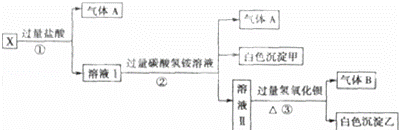
(1)白色沉淀甲是 .
(2)X溶液中一定存在的离子是 .
(3)白色沉淀乙中一定有: ,可能有 .
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 3 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com