
| A、用A的浓度变化表示的该反应平均速率为0.2 mol/(L?s) | B、平衡时A与B的转化率相等 | C、平衡时B的浓度为0.2 mol/L | D、其它条件不变,向容器中再加入1 mol C,达到新平衡时,C的体积分数不变 |
| ||
| 2s |
| 0.8mol |
| 2mol |
| 0.4mol |
| 1mol |
| 0.6mol |
| 2L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
| 催化剂 |
| ||
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
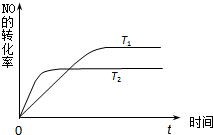
 汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.
汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.| 1 |
| 9 |
| 1 |
| 9 |
| 1 |
| 7 |
| 1 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
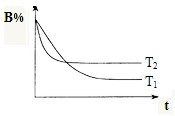 在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空:
在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A、反应在前5min的平均速率为v(SO2)=0.08mol?L-1 min-1 |
| B、保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v(正)>v(逆) |
| C、保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
| D、相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(CO2)=
| ||
| B、到t1 min时,反应未达平衡状态 | ||
| C、保持700℃不变,向平衡体系中再通入0.60molCO和0.30 molH20,达到新平衡时与原平 衡相比,C0转化率增大,H2的体积分数增大 | ||
| D、温度升至800℃时,上述反应的平衡常数为0.64,则正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com