
| A. | $\frac{m}{32}$mol | B. | $\frac{m}{64}$mol | C. | $\frac{n}{11.2}$mol | D. | $\frac{n}{22.4}$mol |
分析 浓硫酸足量,Cu完全反应,根据电子转移守恒计算n(SO2),被还原的H2SO4生成SO2,由S元素守恒可知n被还原(H2SO4)=n(SO2),根据n=$\frac{V}{{V}_{m}}$计算SO2的物质的量,根据S原子守恒可知n被还原(H2SO4)=n(SO2),根据m=nM计算被还原的硫酸,据此解答.
解答 解:mgCu的物质的量=$\frac{mg}{64g/mol}$=$\frac{m}{64}$mol,
反应整个Cu元素化合价由0价升高为+2,S元素化合价由+6降低为+4,根据电子转移守恒有:(6-4)×n(SO2)=2×$\frac{m}{64}$mol,故n(SO2)=$\frac{m}{64}$mol,被还原的H2SO4生成SO2,由S元素守恒可知n被还原(H2SO4)=n(SO2)=$\frac{m}{64}$mol,
由于二氧化硫的体积没有说明是否是标准状况,所以无法计算物质的量,则不能根据SO2来计算被还原的H2SO4的物质的量;
故选B.
点评 本题考查氧化还原反应及计算,为高考常见题型,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2(HCl),将混合气体经饱和NaHSO3溶液洗气后干燥 | |
| B. | NaCl溶液(NaOH),加入适量的盐酸 | |
| C. | Na2O2粉末(Na2O),将混合物在氧气中加热 | |
| D. | FeSO4溶液[Fe2(SO4)3],加入适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 | |
| B. | 工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 | |
| C. | 工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 | |
| D. | 工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化银是一种重要的感光材料,是胶卷中的核心成分之一 | |
| B. | 硅晶体是一种重要的半导体材料,还可用于制造光导纤维 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将塑料废弃物加工成防水材料或汽油,变废为宝 | |
| B. | 煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化 | |
| C. | 食品添加剂必须用天然物质制造 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
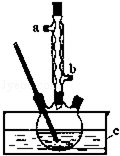 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数x=2 | B. | M的转化率为41.67% | ||
| C. | N的平衡浓度为0.075mol/L | D. | 反应前后混合气体的压强比为$\frac{23}{22}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
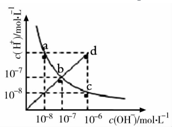
| A. | ac曲线上的任意一点都有c(H+)×c(OH-)=10-14 | |
| B. | CH3COONa溶液不可能位于c点 | |
| C. | d点对应溶液的温度高于25°C,PH<7 | |
| D. | bd线段上任意一点对应的溶液都呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com