
分析 (1)根据方程式计算氧气的体积;
(2)从质量守恒的角度分别计算XY2的物质的量和质量,进而计算摩尔质量;
(3)根据XY2的摩尔质量和X、Y两元素的质量之比计算X、Y的相对原子质量,进而可判断元素的种类.
解答 解:生成物总物质的量为n(XO2)+n(YO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,
由方程式可知,n(XO2):n(YO2)=1:2,
则n(XO2)=0.01mol,n(YO2)=0.02mol,
总质量为:m(XO2)+m(YO2)=0.672L×2.56g/L=1.72g,
(1)设消耗的氧气的体积为V,则
XY2(l)+3O2(g)=XO2(g)+2YO2(g)
1mol 67.2L 1mol 2mol
n V 0.01mol 0.02mol
n=0.01mol,
V=0.672L,即672ml,
故答案为:672ml;
(2)根据质量守恒可知:m(XY2)+m(O2)=m(XO2)+m(YO2)=1.72g,
m(O2)=0.03mol×32g/mol=0.96g,
m(XY2)=1.72g-0.03mol×32g/mol=0.76g
又:n(XY2)=0.01mol,
则:M(XY2)=$\frac{0.76g}{0.01mol}$=76g/mol,
故答案为:76g/mol.
(3)在XY2分子中,X、Y两元素的质量之比为3:16,
则1molXY2分子中,X的质量为76g×$\frac{3}{19}$=12g,Y的质量为:76g-12g=64g,
有1molXY2分子中含有1molX,2molY,
所以:X的相对原子质量为12,Y的相对原子质量为$\frac{64}{2}$=32,
则X为C元素,Y为S元素,
故答案为:C;S.
点评 本题考查化学方程式的计算,题目难度中等,注意从物质的量应用于化学方程式的角度计算,并把握有关物质的量的计算公式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: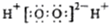 | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | C2H4与C3H6一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的电子式: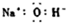 | B. | I4O9(碘酸碘)中碘的化合价为+3,+5 | ||
| C. | NH5的结构式为: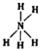 | D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
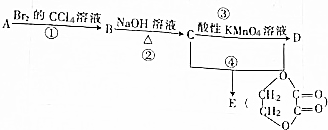 已知:①A的产量通常用来衡量一个国家的石油化工发展水平;
已知:①A的产量通常用来衡量一个国家的石油化工发展水平;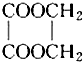 +2H2O,该反应的反应类型是酯化反应或取代反应.
+2H2O,该反应的反应类型是酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
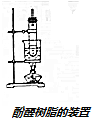 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下: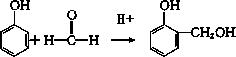
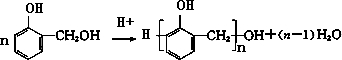
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
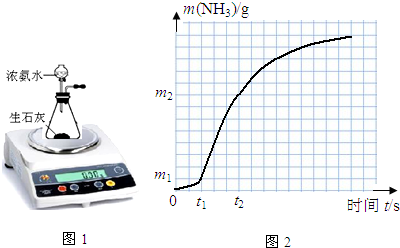
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com