
 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.分析 将甲和丙两气体混合后产生白烟说明是HCl和NH3混合反应生成的丁是氯化铵,依据转化关系A+B=甲,A+D=丙,则判断A为H2,B为N2,D为Cl2,短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.判断C为两个电子层,判断C为O2,A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2,甲为NH3,乙为H2O,丙为HCl,abcd分别为H、N、O、Cl,
(1)将甲和丙两气体混合后产生白烟,则丁为氯化铵为离子化合物;若将甲通入乙中所得溶液PH大于7是氨气和水反应生成一水合氨为弱碱存在电离平衡;
(2)由a、b、c、d四种元素组成的化合物可以是NH4ClO,为离子化合物;
(3)高温时,甲与C在催化剂作用下加热可以发生氨气的催化氧化反应生成一氧化氮和水,铜和硝酸反应生成硝酸铜与NO2、NO的混合气体,反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其相对分子质量;
(4)t℃时,将2molA和2molB通入体积为2L的恒温恒容密闭容器中,发生反应3H2+N2=2NH3,结合化学反应三行计算,气体压强之比等于气体物质的量之比.
解答 解:(1)将甲和丙两气体混合后产生白烟,则丁为氯化铵为离子化合物,由氨根离子与氯离子构成,氯化铵电子式为: ,若将甲通入乙中所得溶液PH大于7是氨气和水反应生成一水合氨为弱碱存在电离平衡电离出氢氧根离子溶液显碱性,NH3•H2O?NH4++OH-,
,若将甲通入乙中所得溶液PH大于7是氨气和水反应生成一水合氨为弱碱存在电离平衡电离出氢氧根离子溶液显碱性,NH3•H2O?NH4++OH-,
故答案为: ;NH3•H2O?NH4++OH-;
;NH3•H2O?NH4++OH-;
(2)由a、b、c、d四种元素组成的化合物可以是NH4ClO,为离子化合物,属于离子晶体,
故答案为:NH4ClO;离子晶体;
(3)n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,
根据氮原子守恒得消耗的n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.2mol=0.6mol;
设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
结合转移电子守恒列方程组为:
x+y=0.2
x+3y=0.2×2
解得x=0.1,y=01,
混合气体平均分子摩尔质量=$\frac{01mol×(30+46)g/mol}{0.2mol}$=38g/mol,
故答案为:0.6 mol;38g/mol;
(4)t℃时,将2molA和2molB通入体积为2L的恒温恒容密闭容器中,发生反应2min时反应达到化学平衡,此时测得反应物B还剩余1.6mol
3H2+N2=2NH3,
起始量(mol) 2 2 0
变化量(mol) 1.2 0.4 0.8
平衡量(mol) 0.8 1.6 0.8
生成甲的平均反应速率=v(NH3)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/(L•min),
平衡时A的转化率=$\frac{1.2mol}{2mol}$×100%=60%,
容器中反应前后的压强比=(2+2):(0.8+1.6+0.8)=5:4,
故答案为:0.2mol/(L•min);60%;5:4.
点评 本题考查了物质性质、结构和转化关系的理解应用和推断,化学方程式书写和计算、化学平衡的计算等,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
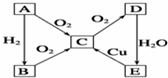 已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:
已知,A为空气中含量最多的单质.根据如图转化关系,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 向Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 | |
| C. | 1molFe(OH)3胶体中含有NA个Fe(OH)3胶体粒子 | |
| D. | 胶体的分散质可以通过过滤从分散剂中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
| A. | NF3分子的立体构型是平面三角形 | |
| B. | 过程N(g)+3F(g)→NF3(g)放出能量 | |
| C. | 反应N2(g)+3F2(g)→2NF3(g)的△H>0 | |
| D. | NF3常温下呈气态,是因为N-F键能大,很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表共7个横行,包含4个短周期和3个长周期 | |
| B. | 元素周期表共16个纵行,包含7个主族、7个副族、1个第Ⅷ族、1个零族 | |
| C. | 第五周期第ⅡA元素与第ⅢA元素原子序数相差11 | |
| D. | 第ⅣA族相邻元素原子序数之差可能为2、8、18、32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH-CH═CH2 1,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | CH3CH2CH(OH)CH3 3-丁醇 | D. | 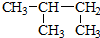 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe | C. | Fe(OH)3 | D. | Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com