
| 选项 | 实验现象 | 原因分析 |
| A | 浓的硫化钠溶液有臭味 | 硫离子多步水解生成硫化氢,硫化氢有臭味 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C | SO2通入溴水中,溴水褪色 | SO2具有漂白性,使其褪色 |
| D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
| A、A | B、B | C、C | D、D |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
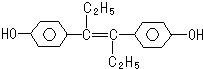
| A、该有机物分子中,至少8个碳原子一定共平面 |
| B、可与NaOH和NaHCO3发生反应 |
| C、1mol该有机物可以与5mol Br2发生反应 |
| D、它易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=8+n | ||
| B、m=10-n | ||
C、m=5-
| ||
| D、m=12-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
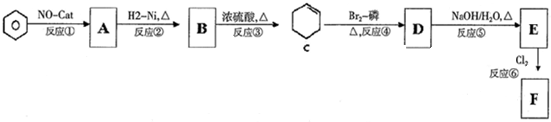
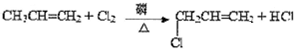 F的结构简式为
F的结构简式为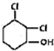
 直接制
直接制 ,理由是
,理由是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4mol、2mol、0mol、2mol |
| B、2mol、1mol、2mol、2mol |
| C、2mol、1mol、2mol、1mol |
| D、2mol、1mol、0mol、1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| B、第一电离能Y不一定小于X |
| C、X与Y形成化合物时,X显负价,Y显正价 |
| D、Y的气态氢化物的稳定性小于X气态氢化物的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
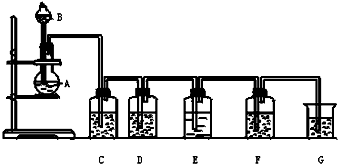 实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:
实验室用如图所示装置制备氯气(加热装置略去),并进行氯气性质实验,请回答下列问题:| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量1mol/L稀盐酸于试管A中,加入少量MnO2,再加入 | |
| 步骤2:取少量1mol/L稀盐酸于试管B中,加入少量MnO2,再加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com