
【题目】碱式碳酸镁可用于牙膏、医药化妆品等工业,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度。某兴趣小组设计了如下两个方案:
方案I:
取一定质量的样品,与硫酸充分反应,通过测定CO2的质量计算纯度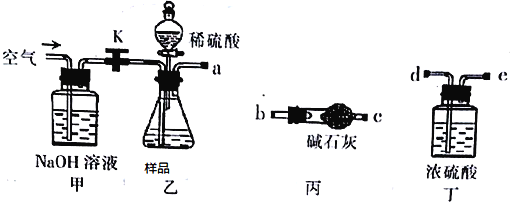
(1)乙中发生反应的方程式为______________________________ 。
(2)仪器接口的连接顺序为(装置可以重复使用) a__________,丁的作用是_________。
(3)关闭止水夹K,向样品中加入足量的稀硫酸,当样品充分反应完后,为了测定准确还应进行的操作是______________________________。
方案Ⅱ:
①称取碱式碳酸镁样品mg;②将样品充分高温灼烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g(用托盘天平称量)。
(4)下列仪器中,该方案不会用到的是____________。
(5)有同学认为方案Ⅱ高温灼烧的过程中会发生MgCO3+SiO2![]() MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点是否正确_____,(填“正确”或“错误”)请说明自己的理由:______________________。
【答案】 4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑ debcb 除去CO2中的水蒸气 打开止水夹K,缓慢通入空气 E 错误 该反应的发生不影响生成CO2和水蒸气的量
【解析】(1)碱式碳酸镁样品中含有的二氧化硅与硫酸不反应,而碱式碳酸镁4MgCO3·Mg(OH)2·5H2O,与硫酸反应生成硫酸镁、二氧化碳和水;反应的方程式为:4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑;正确答案:4MgCO3·Mg(OH)2·5H2O+5H2SO4=5MgSO4+11H2O+4CO2↑。
(2)反应产生的二氧化碳气体中含有水蒸气,要先通过浓硫酸(长进短出)进行气体的干燥,然后纯净干燥二氧化碳被碱石灰吸收,最后称量出干燥管反应前后质量,根据质量差值即可计算出二氧化碳的纯度;外界空气中的水蒸气、二氧化碳进入丙装置,对实验有干扰,所以还要重复用丙装置,减少外界气体对实验带来的误差;仪器接口的连接顺序为:a debcb;丁装置的作用为除去CO2中的水蒸气;正确答案:debcb;除去CO2中的水蒸气。
(3)反应结束后整个装置内会存有少量的二氧化碳气体,这时,打开止水夹K,缓慢通入空气,使反应产生的二氧化碳气体全部被丙装置吸收,减少实验误差;正确答案:打开止水夹K,缓慢通入空气。
(4)给碱式碳酸镁样品加热,冷却、需要用到的仪器:坩埚、三脚架、酒精灯、泥三角、干燥器;用不到的仪器为蒸发皿;正确答案:E。
(5)方案Ⅱ操作过程中,最终测得剩余固体质量,而从样品中溢出的是二氧化碳和水蒸气,只要两种气体的总量不变,固体内部是否反应并不影响实验结果,所以该同学的观点不正确;答案:错误;该反应的发生不影响生成CO2和水蒸气的量。


科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
4NO(g)+6H2O(g) ΔH1=-905.5kJ·mo1—1
②N2(g)+O2(g) ![]() 2NO(g) △H2
2NO(g) △H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下
③NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
4N2(g)+6H2Og) ΔH3=—1625.5 kJ·mo1—1
下列说法不正确的是
A. 反应③一定能自发进行
B. 反应②生成物总能量高于反应物总能量
C. 反应①使用催化剂,反应速率加快,△H1减小
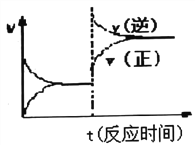
D. 反应③达到平衡后改变条件,v(正)、v(逆)的变化如图所示,则该条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硝酸和浓硫酸的叙述中,正确的是( )
A.露置于空气中,容器内酸液的质量都减轻
B.常温下都能用铝制容器贮存
C.露置于空气中,容器内酸液的浓度都增大
D.常温下都能与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的很多化合物有重要的作用。
(1)羰基硫(COS)可作粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐。则生两种硫酸氢盐的化学式分别是________ 、__________。
(2)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)
![]()
①已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为________________。
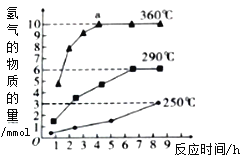
②如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mol)。由图象分析可知,a点时M溶液中除S2O32-外,还一定含有_______(填含硫微粒的离子符号)
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式_________________________。
(3)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10mol·L-1的H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
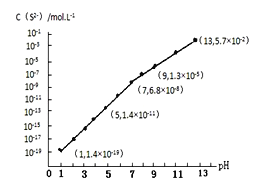
①pH=13时,溶液中的c(H2S)+c(HS-)=____________mol·L-1。
②某溶液含0.020 mol.L-Mn2+、0.10 mol.L-1H2S,当溶液pH=____________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]。
(4)H2S的废气可用烧碱溶液吸收,将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。
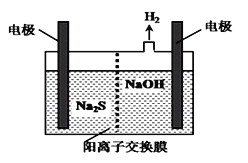
电解过程中阳极区发生如下反应:
S2--2e-=S↓ (n-1)S+S2-![]() Sn2-
Sn2-
①写出电解时阴极的电极反应式:_____________。
②Na2S溶液中离子浓度由大到小顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3。
I .经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④......
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。
要使沉积的FeCl3进入收集器,第④步操作是__________________________。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有_____________。(填步骤序号)
(3) 装置B中的冷水作用为_______________________;
装置C的名称为____________________;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失
效,写出检验FeCl2是否失效的试剂:____________________。
(4)在虚线框内画出尾气吸收装置E并注明试剂___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者相符的是( )
选项 | A | B | C | D |
实 验 |
|
|
|
|
实 验 现 象 | 打开汽水瓶盖时,汽水 会自动喷出来 | 碘溶于水,几乎不溶于 汽油 | 白磷燃烧,产生大量白烟,活塞先向右再向左移,冷却至室温后,最终停在刻度“4”附近 | 空气中,带火星的木条复燃;呼出气体中,带火星的木条熄灭 |
实 验 结 论 | 说明气体在水中的溶解度随压强的增大而减小 | 说明物质的溶解性与溶剂的种类有关 | 氧气约占空气体积的五分之一 | 空气中的氧气比呼出气体中氧气多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列八种物质①丙烯、②甲苯、③聚氯乙烯、④聚异戊二烯、⑤丙炔、⑥环己烷、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是
A. ①③④⑤⑦ B. ④⑤⑦ C. ④⑤ D. ①④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
Y | Y的一种核素质量数为24.中子数为12 |
Z | Z的单质是良好的半导体材料,广泛应用于光电信息领域 |
W | W的最高价氧化物对应水化物是一种不溶于水的蓝色固体 |
回答下列问题:
(1)Y在元素周期表中的位置是________;X、Z的简单气态氢化物稳定性较弱的是____(填化学式)。
(2)X的一种氢化物X2H4的分子中极性键和非极性键数目比为_______;Y的氯化物电子式为________。
(3)W的氧化物(W2O)跟X的最高价氧化物对应的水化物反应生成XO的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期,第________族。
(2)下列推断正确的是________。
A.单质的还原性:Tl>Al
B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3
D.氧化性:Tl3+>Al3+
(3)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子
B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱
D.Tl+的还原性比Ag强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com