
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是 ( )
A.洗气瓶中产生的沉淀是碳酸钡
B.从Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
利用如右图所示的装置收集以下6种气体:①H2 ②Cl2 ③O2 ④HCl ⑤CO2 ⑥SO2
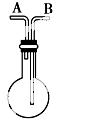 (1)若烧瓶是干燥的,则由B口进气,可收集的气体有________,若由A口进气,可收集的气体有________。
(1)若烧瓶是干燥的,则由B口进气,可收集的气体有________,若由A口进气,可收集的气体有________。
(2)若在烧瓶内充满水,可收集的气体有________,气体应由________口进入。
(3)若烧瓶中装入适量浓硫酸,可以用它来干燥的气体有_____,气体应由____口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置 制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 ( )
制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 ( )
|
| 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
| B | SO2 | 浓硫酸 | Fe | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | Cl2 | 浓盐酸 | MnO2粉末 | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下 表所列的不同实验(气体在同温同压下测定).
表所列的不同实验(气体在同温同压下测定).
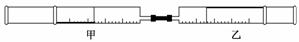
| 实验 序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10 mL FeSO4溶液 | 10 mL NH3 | 生成白色沉淀,后变色 |
| 2 | 20 mL H2S | 10 | |
| 3 | 30 mL NO2 (主要) | 10 mL H2O(l) | 剩有无色气体,活塞自动向内压缩 |
| 4 | 15 mL Cl2 | 40 mL NH3 |
试回答下列问题:
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_________________。
(2)实验2甲针筒内的现象有:有________生成,活塞__________移动(填“向外”、“向内”、“不”).反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________溶液中.
(3)实验3中,甲中的30 mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是________,写出NO2与H2O反应的化学方程式_____________________________________。
(4)实验4中,已知:3Cl2+2NH3===N2+6HCl.甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为____________________,最后针筒内剩余气体的体积约为__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为香芹酮分子的结构,下列有关叙述正确的是
A.香芹酮化学式为C9H12O
B.香芹酮可以发生加成反应、消去反应和氧化反应
C.香芹酮能使酸性KMnO4溶液退色
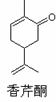 D.香芹酮分子中有3种官能团
D.香芹酮分子中有3种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
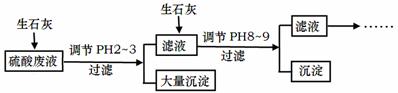
请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9g·L-1,则该溶液中的pH约为 。
(2)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4] c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中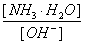 _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃, H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:AsO43-+2I-+2H+= AsO33-+I2+H2O ,SO2+I2+2H2O=SO42-+2I-+4H+ 。上述两个反应中还原性最强的微粒是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
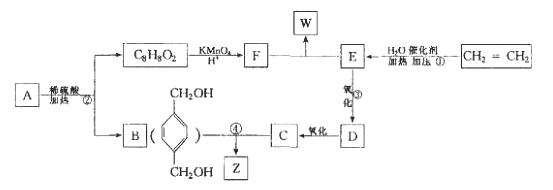
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为_______________,_________________,_______________,______________。
(4)A的结构简式可能为_______________________________________(只写一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com