
| A. | c(Na+)═c(CH3COO-)+c(CH3COOH) | |
| B. | 0.1mol•L-1的CH3COONa溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 将CH3COONa溶解到醋酸中,CH3COONa抑制醋酸的电离 | |
| D. | 等物质的量浓度的CH3COONa、CH3COONH4溶液中c(CH3COO-)不相等 |
分析 A、物料守恒分析解答;
B、CH3COONa溶液是强碱弱酸盐溶液,酸醋根离子要水解;
C、同离子效应;
D、NH4+离子对酸醋根离子的水解起促进作用.
解答 解:A、物料守恒,CH3COONa溶液中,存在:c(Na+)═c(CH3COO-)+c(CH3COOH),故A正确;
B、CH3COONa溶液是强碱弱酸盐溶液,酸醋根离子要水解,所以离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C、同离子效应,所以CH3COONa溶解到醋酸中,醋酸根离子浓度变大,抑制醋酸的电离,故C正确;
D、NH4+离子对酸醋根离子的水解起促进作用,所以CH3COONH4溶液中c(CH3COO-)减小,故D正确;
故选B.
点评 本题考查外界条件对电离平衡的影响,为高频考点,侧重于学生的分析能力的考查,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断,难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得到电子被还原,作氧化剂 | |
| B. | 在金属活性顺序表中,Na排在Cu的前面,所以Na可与CuSO4溶液反应置换出单质Cu | |
| C. | 在氧化还原反应中,不一定所有元素的化合价都发生变化 | |
| D. | 氧化还原反应中,某元素由化合态变为游离态,此元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
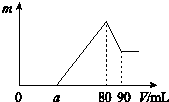 把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.
把一定质量的镁、铝混合物投入到2mol•L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol•L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 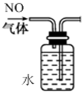 排水法收集NO | |
| B. | 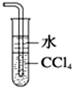 吸收尾气中少量NH3或HCl,并防止倒吸 | |
| C. |  制取并收集少量NH3 | |
| D. | 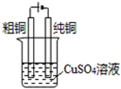 电解精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品包装袋中常放入小袋还原铁粉,目的是防止食品氧化变质 | |
| B. | 铝表面有一层致密的氧化膜,故铝制容器可以用来腌制咸菜等 | |
| C. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
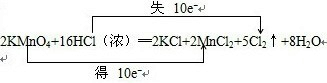 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
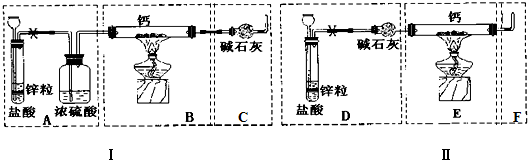
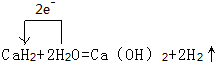 ,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象
,结合上述反应,实验结束后,甲同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成.请你分析该同学的判断是否合理?(填“是”或“否”).若不合理解释原因(若判断合理,此问不用两答)否,金属钙和水反应也有相似的实验现象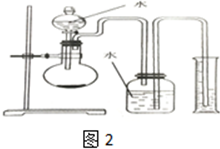
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com