
下列所得溶液的物质的量浓度等于0.1 mol·L-1的是( )
A.将0.1 mol氨充分溶解在1 L水中
B.将10 g质量分数为98%的硫酸与990 g水混合
C.将8 g三氧化硫溶于水并配成1 L溶液
D.将0.1 mol氧化钠溶于水并配成1 L溶液
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G七种短周期主族元素的原子序数依次增大。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大;B、C和F在周期表中相 邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y);D形成的分子为双原子分子。回答问题:
(1)D元素的名称为________,F形成的离子的结构示意图为 _________________________________________________________________ ___。
(2)写出液态化合物Y的一种用途_____________________________________________
____________________________________________________ ____________________。
____________________。
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气 球,请写出该反应的离子方程式______________________________________,
使用这种气球存在的隐患是______________________________________________
________________________________________________________________________。
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质 的量的P和Q恰好完全反应。写出该反应的离子方程式: ________________________________________________________________________
________________________________________________________________________。
(5)A、B、G三种元素两两组合形成的化合物在空气中相遇形成白烟,反应的化学方程 式为
_______________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
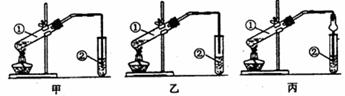
(1)甲、乙、丙三位同学分别设计了如图所示的三套实验装置,请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是 (填“甲”或“乙”)丙同学设计了丙装置,用球形干燥管代替玻璃管,除起到冷凝作用外,另一重要的作用是: 。
(2)浓硫酸的作用是:① ;② 。
(3)右边试管所加试剂是 ,它的作用是中和乙酸、溶解乙醇,还可以是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 ,使用的实验仪器是 。
(5)生成乙酸乙酯的反应是可逆反应,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH固体配制250 mL 0.5 mol·L-1 NaOH溶液,在下列仪器中选出正确的组合:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500 mL容量瓶、⑦药匙、⑧250 mL容量瓶、⑨胶头滴管、⑩坩埚 ( )。
A.①②③④⑥⑨⑩ B.①③④⑦⑧⑨⑩
C.①②③④⑦⑧⑨ D.①②④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中________为________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中________为________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乳酸是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。聚乳酸材料废弃后,先水解成乳酸(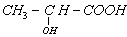 ),乳酸在微生物作用下分解为
),乳酸在微生物作用下分解为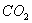 和
和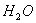 。
。
(1)乳酸的工业生产可以采用生物发酵法。

①检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a. 溴水 b. 银氨溶液 c. 碘酒d. 碘化钾淀粉溶液
②用18吨葡萄糖发酵,理论上可以得到乳酸的质量是___________吨。
(2)乳酸的生产也可以采用有机合成法,其中的一种方法是丙酸法。

①反应I的反应类型是__________反应。
②进行反应II时,需要加入过量的乙醇,这样做的目的是________。
(3)两个乳酸分子之间可以形成环状的酯,该环状酯的结构简式是___________乳酸在一定条件下发生反应得到聚乳酸的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2和Cl2按1∶1体积比(同温同压)混合后通入品红溶液中,品红溶液不褪色,其原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com