
【题目】美国通用原子能公司(GA)提出的碘硫热化学循环是由反应Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( ) 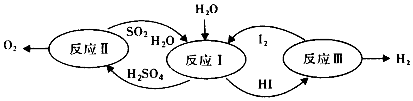
A.设计该循环是为了制取能源气体O2
B.整个循环过程中产生1mol O2的同时产生1molH2
C.图中反应Ⅰ,Ⅱ,Ⅲ均可在常温常压下进行
D.图中反应Ⅰ,Ⅱ,Ⅲ均为氧化还原反应
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 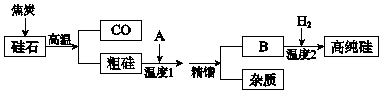
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是( )
A.CaO+H2O═Ca(OH)2
B.CH4+2O2 ![]() 2H2O+CO2
2H2O+CO2
C.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
D.Na2SiO3+2HCl═2NaCl+H2SiO3(胶体)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳.而氢气和氨气都被认为是无碳无污染的清洁能源. 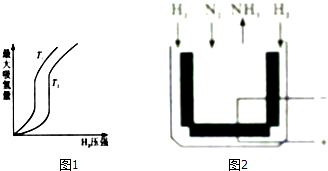
(1)某些合金可用于储存于氢,金属储氢的原理克表示为M+xH2═MH2x(M表示某种合金).如图1表示温度分别为T1、T2且T1<T2时最大吸氢量与氢气压强的关系.则该反应的△H0(填“>”或“<”)
(2)氨在氧气中燃烧,生成水和一种空气组成成分的单质.已知:N2(g)+3H2(g)2NH3(g)△H=﹣92KJmol﹣1及H2的燃烧热为286kJmol﹣1;试写出氨在氧气中燃烧生成液态水的热化学方程式: .
(3)在一定条件下,将1molN2和3molH2混合与一个10L的容积不变的密闭容器中发生反应,5分钟后达到平衡,平衡时氨的体积分数为25%.
①反应的平衡常数表达式为;
②反应开始到平衡时H2的消耗速率v(H2)=;
③能判断该反应是否达到化学平衡状态的依据是;
a 容器中压强不变 b.混合气体的密度不变
c.3v(H2)=2v(NH3) d.c(N2):c(H2):c(NH3)=1:3:2
④对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是;
a 选用更高效的催化剂 b 升高温度c 及时分离出氨气 d 增加H2的浓度
⑤如今采用SCY陶瓷固体电解质的电化学合成氨装置(如图2),该装置用可以传导质子的固态物质作为介质.电池总反应为N2(g)+3H2(g)2NH3(g),那么该电解池阴极反应式为 , 当阳极失去0.6mol电子时,阴极产生的气体在标准状态下的体积为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各原子或离子的电子排布式错误的是( )
A. K+1s22s22p63s23p6
B. F 1s22s22p5
C. S2-1s22s22p63s23p4
D. Ar 1s22s22p63s23p6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2等大气污染气体的处理及利用的方法具有重要意义.用下列装置制备如图1、收集二氧化氮气体,并探究其性质. 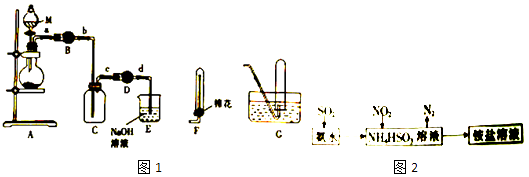
(1)仪器M的名称是 .
(2)干燥管B中盛放的干燥剂是
(3)E中发生反应的化学方程式为 . (填“无水氯化钙”或“碱石灰”)
(4)若用上述装置收集NO气体,采用的收集装置是(城“F”“G”).
(5)利用氨水可以将SO2和NO2吸收,减少污染.同时变废为宝,其原理如图2所示.
①NO2与NH4HSO3反应时,氧化剂与还原剂的物质的量之比为
②某废气中SO2的体积分数为1.5%,某工厂用该方法处理22.4m3时该废气,生成N2体积为 . (气体体积均在标准状况下测定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长式周期表共有18个纵行,从左到右排为1—18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是 ( )
A.s区元素都是金属元素B.第13列的元素原子最外层电子排布为ns2 np1
C.第四周期第9列元素是铁元素D.第10、11列为ds区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com