
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 小苏打可与酸反应,可用作治疗胃酸过多的药剂 | |
| D. | 碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 |
分析 A.氨气易液化,液化时需要吸收大量的热;
B.碳酸氢钠受热分解生成二氧化碳;
C.小苏打为碳酸氢钠,与盐酸反应,消耗氢离子;
D.碳酸钠溶液显碱性是因为碳酸根离子水解,用作锅炉除垢时CaSO4沉淀的转化剂是因为碳酸钙的溶解度小于硫酸钙.
解答 解:A.氨气易液化,液化时需要吸收大量的热,液氨常用作制冷剂,故A错误;
B.NaHCO3用作糕点的膨松剂,是利用碳酸氢钠不稳定受热分解生成二氧化碳,故B错误;
C.小苏打为碳酸氢钠,与盐酸反应,消耗氢离子,可用作治疗胃酸过多的药剂,故C正确;
D.碳酸钠溶液显碱性是因为碳酸根离子水解,用作锅炉除垢时CaSO4沉淀的转化剂是因为碳酸钙的溶解度小于硫酸钙,二者无联系,故D错误;
故选:C.
点评 本题考查了物质的性质与用途之间的联系,熟悉物质的性质是解题关键,注意沉淀转化的规律,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
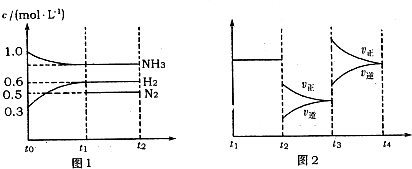
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;非极性键 | ||
| C. | 氢键;极性键;分子间作用力 | D. | 分子间作用力;氢键;非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
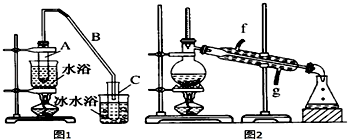

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
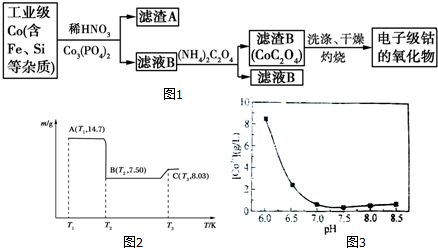
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 常温下,浓度均为0.1 mol•L-1 NaCN、NaHCO3溶液,前者的pH小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N O P | B. | Li Be Mg | C. | C N P | D. | Ar Cl F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
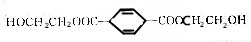 ,有关说法错误的是( )
,有关说法错误的是( )| A. | M的分子式为C12H16O6 | |
| B. | 含有的官能团为羟基、酯基和碳碳双键 | |
| C. | 能发生酯化、水解、加成、氧化等反应 | |
| D. | 1molM能与3molH2加成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com