
某小组同学设想用如图装置电解硫酸钾溶液来
制取氧气、氢气、硫酸和氢氧化钾。
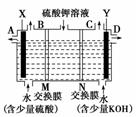
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为________________________________________________________
________________________________________________________________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为________。
解析:题图中左边加入含硫酸的水,暗示左边制硫酸,即OH-在阳极发生氧化反应,使左边溶液中H+增多,为了使溶液呈电中性,硫酸钾溶液中的SO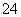 通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-===4OH-,负极反应式为2H2-4e-+4OH-===4H2O。(4)n(H2)=0.5 mol,2H++2e-===H2↑,得电子为1 mol,X极的反应式为4OH--4e-===2H2O+O2↑或2H2O-4e-===4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 molH2SO4,m(H2SO4)=49 g。
通过M交换膜向左边迁移,即M为阴离子交换膜,由此推知X为阳极,与电源正极相连,B出口产生氧气,A出口流出硫酸;同理,右侧加入含KOH的水,说明右边制备KOH溶液,H+在Y极发生还原反应,说明Y极为阴极,与电源负极相连,右边溶液中OH-增多,硫酸钾溶液中K+向右迁移,N为阳离子交换膜。所以,C出口产生氢气,D出口流出KOH溶液。(3)若将制得的氢气和氧气在氢氧化钾溶液中构成原电池,正极反应式为O2+2H2O+4e-===4OH-,负极反应式为2H2-4e-+4OH-===4H2O。(4)n(H2)=0.5 mol,2H++2e-===H2↑,得电子为1 mol,X极的反应式为4OH--4e-===2H2O+O2↑或2H2O-4e-===4H++O2↑,根据电子守恒知,生成H+的物质的量为1 mol,故生成0.5 molH2SO4,m(H2SO4)=49 g。
答案:(1)正 C (2)阴离子 阳离子 (3)H2-2e-+2OH-===2H2O (4)49g 6.02×1023


科目:高中化学 来源: 题型:
褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
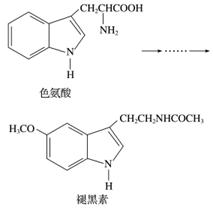
下列说法不正确的是( )
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出
C.在一定条件下,色氨酸可发生加聚反应
D.褪黑素与色氨酸结构相似,也具有两性化合物的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO3和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:A:________、B:________、C:________、D:________、E:________。
(2)用电子式表示离子化合物A2B的形成过程:__________________________________。
(3)写出下列物质的电子式:
①D元素形成的单质:___________________________________________________。
②E与B形成的化合物:_________________________________________________。
③A、B、E形成的化合物:_____________________________________________________。
④D与E形成的化合物:_____________________________________________。
⑤C、D、E形成的离子化合物:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。

A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级
B.在电解过程中,H+向阳极移动,SO 向阴极移动
向阴极移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+===2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定条件下合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
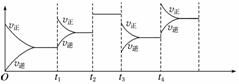
t1____________;t2______________;t3______________;
t4____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等压条件下,可逆反应2A(g)+B(g)3C(g)+D(g)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡后,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )

A.甲容器中A的反应速率为0.1 mol·L-1·min-1
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙中A的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。
工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。
工艺流程如图所示。
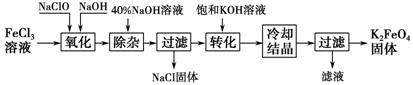
(1)完成“氧化”过程中反应的化学方程式:
FeCl3+____NaOH+____NaClO→____Na2FeO4+____+____。其中氧化剂是____(填化学式)。
(2)“转化”过程中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。
以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO,该电极反应方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com