
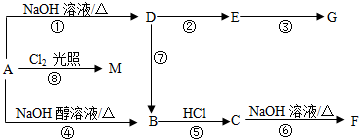
分析 有机化合物A的相对分子质量为92.5,含有碳、氢、氯三种元素,由于Cl元素相对原子质量为35.5,可推知A中含有1个Cl原子,A中氢的质量分数为9.73%,则分子中N(H)=$\frac{92.5×9.73%}{1}$=9,故N(C)=$\frac{92.5-35.5-9}{12}$=4,故A的分子式为C4H9Cl,A经过系列转化得到F,由转化关系可知B为烯、C为一氯丁烷、F为丁醇,F的核磁共振氢谱有两种吸收峰,其峰面积之比为9:1,可推知F为(CH3)3COH,逆推可知C为(CH3)3CCl,B为(CH3)2C=CH2,A发生水解反应生成D,D为醇,D转化生成E,E转化生成G,E和G都能和新制的Cu(OH)2悬浊液反应,但反应类型不同,则E为醛、G为羧酸,可推知A为(CH3)2CHCH2Cl,顺推可知D为(CH3)2CHCH2OH、E为(CH3)2CHCHO、G为(CH3)2CHCOOH,据此解答.
解答 解:有机化合物A的相对分子质量为92.5,含有碳、氢、氯三种元素,由于Cl元素相对原子质量为35.5,可推知A中含有1个Cl原子,A中氢的质量分数为9.73%,则分子中N(H)=$\frac{92.5×9.73%}{1}$=9,故N(C)=$\frac{92.5-35.5-9}{12}$=4,故A的分子式为C4H9Cl,A经过系列转化得到F,由转化关系可知B为烯、C为一氯丁烷、F为丁醇,F的核磁共振氢谱有两种吸收峰,其峰面积之比为9:1,可推知F为(CH3)3COH,逆推可知C为(CH3)3CCl,B为(CH3)2C=CH2,A发生水解反应生成D,D为醇,D转化生成E,E转化生成G,E和G都能和新制的Cu(OH)2悬浊液反应,但反应类型不同,则E为醛、G为羧酸,可推知A为(CH3)2CHCH2Cl,顺推可知D为(CH3)2CHCH2OH、E为(CH3)2CHCHO、G为(CH3)2CHCOOH.
(1)A的结构简式为(CH3)2CCH2Cl,故答案为:(CH3)2CCH2Cl;
(2)反应⑦是(CH3)2CHCH2OH在浓硫酸、加热条件下发生消去反应生成(CH3)2C=CH2,
故答案为:浓硫酸、加热;
(3)(CH3)2CHCH2OH的两种相同类别的同分异构体在Ⅱ中没有出现,结构简式分别为:CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3,
故答案为:CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3;
(4)E和新制的Cu(OH)2悬浊液反应方程式为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$Cu2O+(CH3)2CHCOONa+3H2O;
反应⑤的反应方程式为:(CH3)2C=CH2+HCl→(CH3)3CCl
故答案为:(CH3)2CHCHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$Cu2O+(CH3)2CHCOONa+3H2O;(CH3)2C=CH2+HCl→(CH3)3CCl
(5)分子式为C4H2Cl8的有机物可以看作C4Cl10中的两个Cl原子被两个H原子取代,可以采取“定一移二”法确定: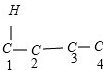 、
、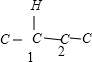 、
、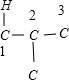 ,故C4H2Cl8共有9种,
,故C4H2Cl8共有9种,
故答案为:9.
点评 本题考查有机物的推断,计算确定A的分子式并结合转化关系确定A的结构是关键,需要学生熟练注意官能团的性质与转化,对学生的理解推理有一定要求,难度中等,(6)中同分异构体书写,注意利用定一移二方法解答.


科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极发生反应的物质是Li1-xCoO2 | |
| B. | 充电时,阴极发生氧化反应 | |
| C. | 放电时,Li+由负极向正极迁移 | |
| D. | 充电时,阳极的电极反应式为:xLi++nC+xe-=LixCn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与足量Ba(OH)2溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 硫化钠的水解反应:S2-+2H2O?H2S+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 单质铜与稀硝酸反应:Cu+2H++2NO3-═Cu2++2NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A元素与C元素形成的分子不可能是非极性分子 | |
| B. | A、C、D元素分别与氢元素形成的最简单氢化物中,D的氢化物沸点最高 | |
| C. | A、B、C、D四种元素的基态原子中,B的原子半径最大 | |
| D. | A、B、C、D 四种元素对应单质的晶体都是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两份均为18g的Al片分别与足量的盐酸和NaOH溶液充分转移电子总数均为2NA | |
| B. | 1 molCu和2 mol热浓硫酸充分反应,可生成NA个SO2分子 | |
| C. | 标准状况下,14g N2和C2H4混合气体的体积为11.2L | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
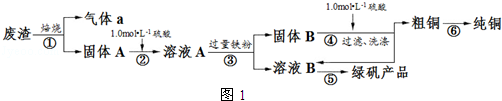
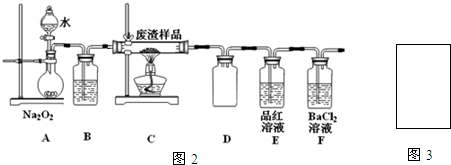
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com