
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( ) 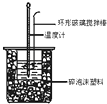
A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验比用 50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
【答案】C
【解析】解:A.中和热的含义是稀的强酸和强碱溶液反应生成1mol水的过程中所放出的热量,用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,和用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行求出的中和热数值相同,故A正确; B.在中和热的测定过程中,为了保证结果实验准确,采用的酸碱中,往往保证一方过量,让另一方充分反应,故B正确;
C.在中和热的测定过程中,酸碱混合时要迅速,防止热量的散失,保证放出的热量都体现在温度计温度的升高上,故C错误;
D.中和热测定实验成败的关键是做好保温工作,实验中,大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失,故D正确.
故选C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因 .
(2)哪一段时段的反应速率最小 , 原因是 .
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水
B.CH3COONa固体
C.Na2CO3溶液
D.CuSO4溶液你认为可行的是(填编号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列在理论上可设计成原电池的化学反应是( )
A. C(s)+H2O(g)=CO(g)+H2 (g)
B. Ba(OH)28H2O(s)+2NH4C1(s)=BaCl2(aq)+2NH3H2O(l)+8H2O(l)
C. C(s)+CO2(g)=2CO(g)
D. CH4(g)+2O2(g)→CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
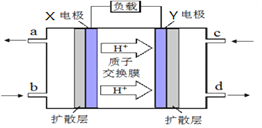
【题目】按照下列图表和有关要求回答问题:
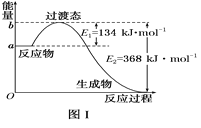
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_________(填“增大”“减小”或“不变”,下同),ΔH的变化是_________。请写出NO2和CO反应的热化学方程式:___________________________。
(2) 甲醇既是重要的化工原料,又可作为燃料。
Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g) ΔH1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)=CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O |
| H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=_________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=______kJ·mol-1。
Ⅱ.甲醇质子交换膜燃料电池的工作原理如上图所示,写出X电极的电极反应式_______________。
(3) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 4.0 g H218O中所含电子数为2 NA
B. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
C. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com