
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐滴加入等浓度的盐酸,溶液中pOH [pOH=-lg c(OH-)]与pH的变化关系如图所示。下列说法不正确的是
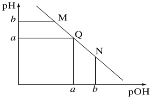
A.M点和N点溶液中H2O的电离程度相同
B.Q点溶液中,c(H+)=c(OH-),pH =7
C.M点溶液的导电性小于Q点溶液的导电性
D.N点溶液加水稀释,![]() 变小
变小
【答案】B
【解析】
碱溶液中pOH越大、pH越小,说明溶液中氢氧根离子浓度越小,氢离子浓度越大,碱性越弱、酸性越强,随着盐酸的加入,发生中和反应,溶液氢氧根离子的浓度逐渐减小,则溶液pH逐渐减小,pOH逐渐增大,结合弱电解质的电离解答该题。
A、由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故A正确;
B; Q点时pH= pOH,说明c(OH-)=c(H+),溶液呈中性,但是并不一定为常温,pH不一定等于7,故B错误;
C.、M点溶液中主要溶质为一水合氨,为弱电解质,在溶液中部分电离,溶液中离子浓度较小,Q点溶液中主要为氯化铵,为强电解质,溶液中离子浓度较多,所以M点的导电能力小于Q点,故C正确;
D、N点溶液加水稀释,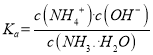 ,温度不变,Ka不变,加水稀释氢离子浓度减小,c(OH-)增大,所以
,温度不变,Ka不变,加水稀释氢离子浓度减小,c(OH-)增大,所以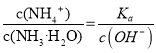 变小,故D正确;
变小,故D正确;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】国际贸易可以互通有无,符合国际社会的根本利益,下列贸易商品中,主要成分属于无机物的是
A.巴西铁矿砂 | B.沙特石油 | C.俄罗斯天然气 | D.中国丝绸 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属都能与氧气反应:
(1)已知1.4 g锂在空气中加热充分反应,可生成3.0 g氧化物,写出该反应的化学方程式: ______。
(2)将一小块金属钠、钾分别投入到加热的坩埚中,观察到的实验现象是____________,有关反应的化学方程式是______________。
(3)由上述实验得出的结论是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种锂离子电池的反应式为 LixC6 + Li1xCoO2![]() 6C+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是
6C+LiCoO2(x<1)。其工作原理如图所示。下列说法不正确的是
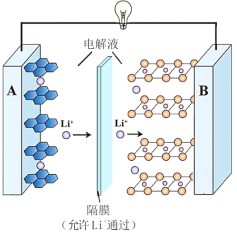
A.放电时,A 极电极式为:LixC6 xe = 6C + xLi+
B.放电时,若转移 0.3 mol 电子,石墨电极将减重 2.1g
C.充电时,Li+从左向右移动
D.若要从废旧该型锂电池的正极材料中回收锂元素,先进行放电处理,有利于 Li+尽可能从负极脱出,在正极富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素的物质只有还原性是___。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化,写出操作过程、现象及结论。答:___。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___(填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:__Fe(OH)3+__ClO-+__=__FeO42-+__Cl-+___
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
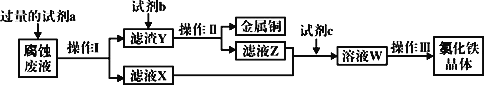
回答下列问题:
①试剂a是___,操作I用到的玻璃仪器有烧杯、玻璃棒和___。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___。
③写出FeCl3溶液与金属铜发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
Ⅰ.一定条件下(T ℃、1.01×105 Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/kJ/mol | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式:___________________________________________。
Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) ![]() 2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比
2NOCl(g) ΔH<0。保持恒温恒容条件,将物质的量之和为3 mol的NO和Cl2以不同的氮氯比![]() 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
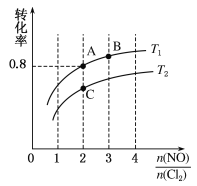
(1)图中T1、T2的关系为T1________T2(填“>”“<”或“=”)。
(2)图中纵坐标为物质________的转化率,理由为_________________________________。
(3)图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”“B”或“C”)。
(4)若容器容积为1 L,经过10min到达A点,该时间段内化学反应速率υ(NO)=_________。B点的平衡常数为________。
(5)若在温度为T1,容积为1 L的容器中,充入0.5mol NO、1mol Cl2、2mol NOCl,υ(正)_____υ(逆) (填“<”“>”或“=”),理由为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:
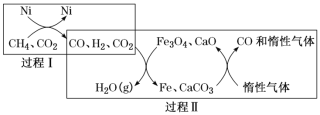
①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;
过程I的热化学方程式为_______。
②关于上述过程II的说法不正确的是______(填字母)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2H2O(g)+CO c.CO未参与反应 d.Fe3O4、CaO为催化剂,降低了反应的ΔH
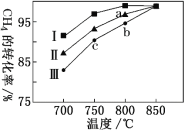
③其他条件不变,在不同催化剂(I、II、III)作用下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点是否达到平衡状态?________(填“是”或“否”);b点CH4的转化率高于c点,原因是________。
(2)在刚性密闭容器中,加入CH4和CO2,二者分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1123 K使其发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4) ·p(CO2)。(单位忽略),某时刻测得p(CO)=20 kPa,则p(CO2)=________kPa,v(CO)=________(单位忽略)。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________。(用各物质的分压计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是
A. 16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. pH=1的H3PO4溶液中,含有0.1NA个H+
D. 10 g的D2O中含有的质子数与中子数分别为5NA和4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com