
【题目】制备氰氨基化钙的化学方程式为CaCO3+2HCN![]() CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
A. 氢元素被氧化, 碳元素被还原
B. HCN被氧化, CaCO3被还原
C. HCN是氧化剂, CaCO3是还原剂
D. CaCN2是氧化产物, H2为还原产物
【答案】D
【解析】
CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑中,N元素化合价不变,生成物CO2中碳元素来自碳酸钙,它的化合价没有发生变化,生成物CO中碳元素来自HCN,C的化合价没有发生变化,HCN中的H原子得电子由+1价变为0价(2个H原子),得到H2,HCN中的C原子失电子,由+2价变为+4价(1个C原子),得到CaCN2。
因HCN中的碳元素化合价升高,氢元素的化合价降低,则氢元素被还原,碳元素被氧化,A错误;因HCN中的碳元素化合价升高,氢元素的化合价降低,则HCN既是氧化剂又是还原剂,碳酸钙中没有元素的化合价发生变化,既不是氧化剂也不是还原剂,B、C错误;HCN中的碳元素化合价由+2升高到+4,对应的氧化产物为CaCN2,HCN中的氢元素化合价由+1价降低到0,对应的还原产物为H2,D正确。
故选D。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述错误的是
A.100g 9.8%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
B.向100mL0.1 mol/L 醋酸溶液中加入CH3COONa固体至溶液刚好为中性,溶液中醋酸分子数为0.01NA
C.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等
D.含2.8g硅的SiO2晶体中存在的共价键总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CP是一种起爆药,化学式为[Co(NH3)5(C2N5)](ClO4)2。CP可由5-氰基四唑(分子式为HC2N5,结构简式如图1所示)和[Co(NH3)5(H2O)](ClO4)3反应制备。
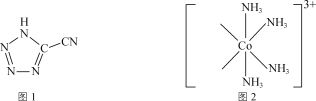
(1)CP中Co3+基态电子排布式为___。
(2)5-氰基四唑中C原子的杂化类型为__,所含C、N元素的电负性的大小关系为C__(填“>”“=”或“<”)N。1mol5-氰基四唑中含有σ键的数目为__。
(3)[Co(NH3)5(H2O)](ClO4)3中的配离子部分结构如图2所示。
①请在相应位置补填缺少的配体___。
②与NH3互为等电子体的一种阳离子为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A. 碳与热的浓硫酸反应的化学方程式:C+2H2SO4(浓)![]() CO↑+2SO2↑+2H2O
CO↑+2SO2↑+2H2O
B. 乙炔燃烧的化学方程式:2C2H2 +5O2 ![]() 4CO2 +2H2O
4CO2 +2H2O
C. 氯化氢在水中的电离方程式:HCl=H+ +Cl-
D. 氯化铵水解的离子方程式:NH4++H2O ![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X为具有浓郁香味、不易溶于水的油状液体,食醋中约含有3%-5%的D,其转化关系如下图所示。
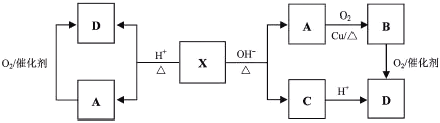
请回答:
(1)X的结构简式是__________________。
(2)A→B的化学方程式是____________________________________________。
(3)下列说法不正确的是________。
A.A+D→X的反应属于取代反应
B.除去X中少量D杂质可用饱和Na2CO3溶液
C.A与金属钠反应比水与金属钠反应要剧烈得多
D.等物质的量的A、B、D完全燃烧消耗O2的量依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________。
(4)装置B中生成NaClO2的化学方程式是____。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___;b._____;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向 Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由 Na 和 C1 形成离子键的过程:![]()
D.NaHSO4熔融电离:NaHSO4![]() Na++H++SO42-
Na++H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com