
| A. | Z的浓度可能为0.3mol/L | |
| B. | 平衡时X2、Y2的转化率相等 | |
| C. | 平衡时,Y2和Z的生成速率之比为2:1 | |
| D. | 若平衡后再改变外界条件,升高温度,则反应的平衡常数将变大 |
分析 A.X2的起始浓度分别为0.1mol/L,若完全转化生成Z为0.2mol,该反应为可逆反应,则Z的浓度小于0.4mol;
B.Z的浓度极限转化为反应物时,相当于X2、Y2的起始浓度分别为0.2mol/L、0.4mol/L,而反应时转化的量为1:1;
C.平衡时,不同物质的正逆反应速率之比等于化学计量数之比;
D.该反应可能为吸热反应或放热反应,若为放热反应,升高温度,平衡逆向移动.
解答 解:A.X2的起始浓度分别为0.1mol/L,若完全转化生成Z为0.2mol,该反应为可逆反应,则Z的浓度小于0.4mol,可知平衡时Z的浓度可能为0.3mol/L,故A正确;
B.Z的浓度极限转化为反应物时,相当于X2、Y2的起始浓度分别为0.2mol/L、0.4mol/L,而反应时转化的量为1:1,可知转化率一定不相等,故B错误;
C.平衡时,不同物质的正逆反应速率之比等于化学计量数之比,则平衡时,Y2和Z的生成速率之比为1:2,故C错误;
D.若为放热反应,升高温度,平衡逆向移动,则化学平衡常数减小,故D错误;
故选A.
点评 本题考查化学平衡的计算,为高频考点,把握可逆反应的特点、转化率计算、平衡判定、平衡常数与温度的关系为解答的关键,侧重分析与计算能力的考查,注意极限转化法应用及选项D中焓变未知,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式 C2H4O2 | B. | 氯化钠的电子式: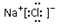 | ||
| C. | 硫原子的原子结构示意图: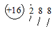 | D. | 水的电离方程式 2H2O═H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
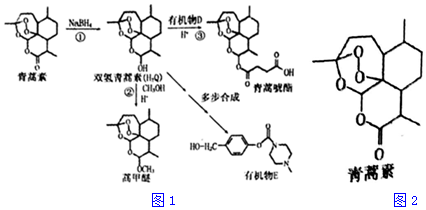
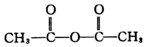 +H-OH→
+H-OH→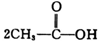
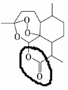 ;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-.
;根据酯的性质判断青蒿素可能具有的某种化学性质和反应条件为可在酸性或碱性条件下发生水解反应.屠呦呦教授率领的研究团队先后经历了用水、乙醇、乙醚提取青蒿素的探究过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素;研究发现这是因为青蒿素分子中的某个基团在提取过程中对热不稳定,试写出该基团的结构式-O-O-. .
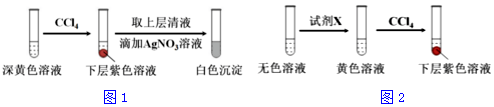
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式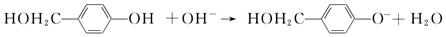 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、M的离子半径为M<W | |
| B. | YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Z与X形成的化合物的熔沸点偏高是因其分子内存在氢键 | |
| D. | Z与M形成的化合物可作为耐高温材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
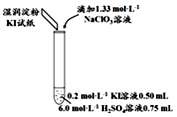 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数相等 | |
| B. | 常温常压,16g氧气与臭氧的混合物,氧原子为NA | |
| C. | 一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| D. | 常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na能与CuSO4溶液反应置换出红色的铜 | |
| B. | Na2O是碱性氧化物,与酸反应生成盐和水 | |
| C. | Na2O和Na2O2都能与水反应,生成物完全相同 | |
| D. | Na2O2是白色固体,可用于呼吸面具中氧气的来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com