
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |
分析 X、Y、Z、M、W为五种短周期元素,W在短周期主族元素中原子半径最大,W为Na元素,Y与M形成的气态化合物在标准状况下的密度为0.76g•L -1,该化合物的摩尔质量为0.76g•L -1×22.4L/mol=17g/mol,考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素.X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z是原子序数依次递增的同周期元素,则最外层电子数依次增大,最外层电子数之和为15,X、Z的最外层电子数之和为15-5=10,故Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素.
解答 解:X、Y、Z、M、W为五种短周期元素,W在短周期主族元素中原子半径最大,W为Na元素,Y与M形成的气态化合物在标准状况下的密度为0.76g•L -1,该化合物的摩尔质量为0.76g•L -1×22.4L/mol=17g/mol,考虑为NH3,X、Y、Z是原子序数依次递增的同周期元素,故Y为N元素,M为H元素.X与Z可形成XZ2分子,则X位于偶数族,X、Y、Z是原子序数依次递增的同周期元素,则最外层电子数依次增大,最外层电子数之和为15,X、Z的最外层电子数之和为15-5=10,二故Z最外层电子数为偶数,二者平均最外层电子数为5,故Z处于第ⅥA族,X处于第ⅣA族,所以X为C元素,Z为O元素,
A、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>C>N,即W>X>Y,故A错误;
B、X为C元素、M为H元素,两元素形成的化合物甲烷为正四面体、乙烯为平面结构、乙炔为直线型,故B正确;
C、Na单质与水反应后的溶液为氢氧化钠溶液,将CO2通入氢氧化钠溶液中,当n(CO2):n(NaOH)介于1:1与1:2之间时会生成碳酸钠、碳酸氢钠,故C错误;
D、M为H元素,Z为O元素,由Z、M两种种元素形成的化合物如H2O2中含有极性键和非极性键,故D错误;
故选B.
点评 本题考查元素推断、元素周期律、分子结构及C、N、Na元素化合物性质等,难度中等,根据密度判断Y与M形成的气态化合物是氨气是推断的关键,注意X、Z元素推断奇偶性的利用.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 | 离子反应 |
| A | 向FeCl2溶液中加入Zn片 | 浅绿色溶液变为无色 | Zn具有还原性 | Fe2++Zn═Zn2++Fe |
| B | 向FeCl2溶液中滴新制氯水 | 浅绿色溶液变为棕黄色 | Fe2+具有还原性 | 2Fe2++Cl2═2Fe3++2Cl- |
| C | 向FeCl3溶液中加入铁粉 | 棕黄色溶液变为浅绿色 | Fe具有还原性 | Fe+Fe3+═2Fe2+ |
| D | 向FeCl3溶液中加入铜粉 | 蓝色溶液变为棕黄色 | Fe3+具有氧化性 | Fe3++Cu═Fe2++Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
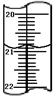 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
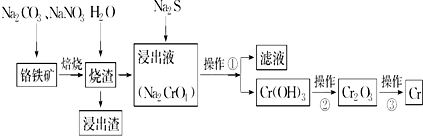
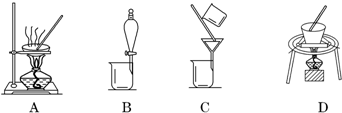
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | KAl(SO4)2水解可生成Al(OH)3胶体,可用于自来水的净化 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
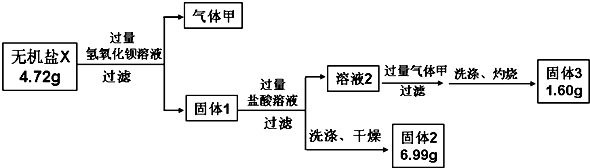
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测食盐水的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所取溶液体积偏小 | |
| D. | 中和滴定实验时,锥形瓶先用蒸馏水再用待测液润洗,所测溶液浓度偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com