
| A. | 25℃和l00℃时H2O的KW | |
| B. | 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) | |
| C. | 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH | |
| D. | 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
分析 A、水的电离是吸热的过程,水的离子积只受温度的影响;
B、同温同浓度的KHCO3溶液和NH4HCO3溶液中的碳酸氢根离子的水解程度不相同;
C、NaHCO3溶液和CH3COONa溶液中的阴离子的水解程度不相同,所以酸碱性不同;
D、氢氧化钠和一元酸反应时,恰好中和,酸、碱的物质的量相同.
解答 解:A、水的电离是吸热的过程,水的离子积只受温度的影响,温度越高,水的Kw越大,所以25℃时H2O的KW小于l00℃时H2O的KW,故A正确;
B、同温同浓度的KHCO3溶液和NH4HCO3溶液中的碳酸氢根离子的水解程度不相同,后者铵根离子的存在促进碳酸氢根离子的水解,所以溶液中的c(HCO3-)前者大于后者,故B错误;
C、醋酸酸性强于碳酸,所以碳酸氢根离子的水解程度大于醋酸根离子的水解程度,NaHCO3溶液的pH大于CH3COONa溶液,故C错误;
D、中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量是相等的,故D错误.
故选A.
点评 本题考查水的离子积的影响他因素以及盐的水解原理知识,注意盐的水解规律:越弱越水解的应用是关键,难度中等.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1>10v2 | |
| B. | 加少量水稀释,氨水中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$都减小 | |
| C. | v2≈v3 | |
| D. | 中和热A=B=C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑩ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.
Fe(OH)3+3H+△H>0,平衡正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
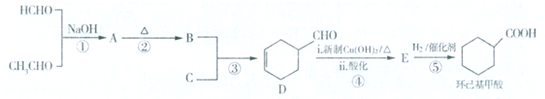
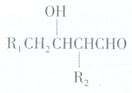 或
或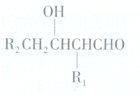
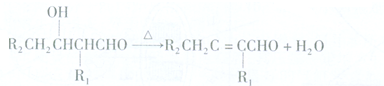
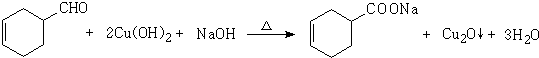 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液法分离碘酒和CCl4 | |
| B. | 用饱和碳酸钠溶液萃取乙醇中的乙酸 | |
| C. | 用银氨溶液鉴别甲酸乙酯和乙醛 | |
| D. | 用浓溴水鉴别苯和环己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
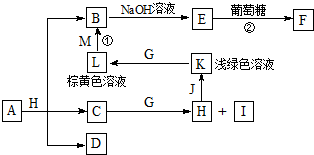 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
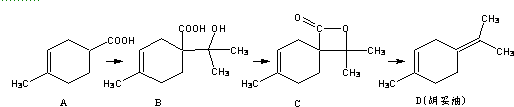
| A. | 1molA可与2molNaOH完全反应 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com