
【题目】惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。

回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是________________________________。
②E与少量CO2反应的离子方程式是________________________________。
③常温下,若电解100mL 0.1 mol/L NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为___(忽略反应前后溶液的体积变化及气体溶于水的影响)。
(2)若电解的是CuSO4溶液,加热时,A的浓溶液可与B发生反应:
①A的浓溶液与B反应过程中,A的浓度随时间变化的图像正确是_________。

②E的化学式是______________;电解时阳极的电极反应式是___________________。
③若CuSO4溶液足量,电解后要恢复原来的浓度可加入 ________。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ClO-+CO2+H2O=HClO+HCO3- 13 A SO2 4OH- -4e-=O2+2H2O 或2H2O-4e-=O2+4H+ CuO或CuCO3
【解析】(1)电解NaCl溶液生成NaOH、H2和Cl2,A+B→E+NaCl,说明A、B为NaOH和Cl2,C为H2,E是NaClO;甲是短周期元素的单质,是日常生活中常用的包装材料,甲+A→D+H2,则A是NaOH,甲是Al,B是Cl2。
①甲与A反应生成偏铝酸钠和氢气。故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②E与少量CO2反应,即NaClO与少量CO2反应,生成HClO与HCO3-;
故答案为:ClO-+CO2+H2O=HClO+HCO3-。
③常温下,若电解100mL 0.1mol/LNaCl溶液,阴、阳两极各产生112mL气体(标况),即阴阳极分别产生0.005mol H2和Cl2。由2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,可得:
2NaOH+H2↑+Cl2↑,可得:
n(OH-)=2n(Cl2)=0.01mol,c(OH-)=0.1mol/L,pH=13。
故答案为:13;
(2)若电解的是CuSO4溶液,生成的产物为Cu、O2和H2SO4,加热时,A的浓溶液可与B发生反应说明A为H2SO4,B为Cu,C为O2。
①A的浓溶液与B反应过程中,即浓硫酸和Cu反应,随着反应的进行,硫酸浓度减小,②铜和稀硫酸不发生反应,A的浓度随时间变化的图象是开始浓度减小,最后浓度不变。
故答案为:A;
②E是铜和浓硫酸加热反应生成SO、水和硫酸铜,所以E为SO2,电解时阳极是OH-放电,故电极反应为:4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+。
故答案为:SO2;4OH--4e-=2H2O+O2↑或2H2O-4e-=O2↑+4H+。
③若CuSO4足量,则阴极产物只有Cu,阳极是O2,且二者物质的量之比为2∶1;若要将溶液恢复到原来的浓度,可加入CuO固体,或者CuCO3固体,CuCO3+2H+=Cu2++H2O+CO2↑)。
故答案为:CuO或CuCO3


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下图表示四个单体构成的化合物。下列叙述错误的是
A. 若单体是四种氨基酸,则该化合物为四肽,彻底水解后的产物再重新组合成四肽,共有24种排列组合
B. 若单体是葡萄糖,则该化合物为四糖,其水解成两分子二糖时,该二糖能与斐林试剂发生特定颜色反应
C. 若单体是四种脱氧核苷酸,则该化合物有A、U、C、G四种含氮碱基,彻底水解的产物中有磷酸、一种单糖和四种含氮碱基
D. 若单体是四种核苷酸,则该化合物一定含有A、C、G三种含氱碱基,水解后的产物再重新组合在一起,共有24种组合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的俗名与化学式一致的是
A. 铁红——Fe2O3 B. 水玻璃——Na2SiO3
C. 纯碱——NaOH D. 明矾——KAl(SO4)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水、废气、废渣的处理是减少污染、保护环境的重要措施.
(1)烟气中的NOx必须脱除(即脱硝)后才能排放. ①列举一种由NOx引起的大气污染现象: .
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=﹣890.3kJmol﹣1
N2(g)+O2(g)═2NO(g);△H=+180kJmol﹣1
则CH4脱硝的热化学方程式为CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H= .
③图1是一种用NH3脱除烟气中NO的原理.该脱硝反应中,氧化剂是;
(2)图2是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水.图中有机废水中有机物可用C6H10O5表示. 
①电池正极为 . (填“a”或“b”)
②电极a上的电极反应式为 .
③电池工作过程中Na+离子移向、Cl﹣离子移向 . (填“a电极”、或“b电极”)
④假设咸水中氯化钠的质量分数为2.34%,当两极总共产生7.84L气体(标准状况下)时,理论上处理咸水g.(忽略CO2的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 溴在海水中以化合态形式存在
B. 从海水中提取溴要经历浓缩、氧化和提取三个步骤
C. 提取金属镁是电解氯化镁的熔融液
D. 溴在常温下是液态,其颜色与氯气颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化, 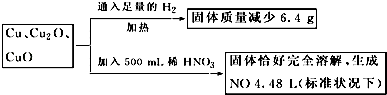
则转化过程中所加稀HNO3的物质的量浓度为( )
A.4.4 molL﹣1
B.3.6 molL﹣1
C.4.0 molL﹣1
D.3.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要的危害是形成光化学烟雾,危害人类健康.HNCO可用于消除汽车尾气中的NO和NO2 , 其反应原理为:HNCO+NOx→N2+CO2+H2O,下列说法正确的是( )
A.CO2分子中既含有极性键又含有非极性键
B.4.3g HNCO中含有0.1NA个原子
C.反应中NOx是还原剂
D.若NOx中x=2,1mol NO2在反应中转移4NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com