
已知下列反应在一定条件下可以发生:
H2O2+2Fe2++2H+=2Fe3++2H2O;
H2O2+2Fe3+=2Fe2++2H++O2↑
在以上反应中Fe2+实际起着________作用,总反应式为________
科目:高中化学 来源:山东省青州一中2012届高三化学一轮跟踪训练:第11章 第6讲 有机合成与推断(鲁科版) 题型:022
已知烯烃在一定条件下可被强氧化剂氧化成酸或酮.例如:
RCH![]() CH
CH![]()
![]() RCOOH+
RCOOH+![]() COOH
COOH
某同学从A出发研究下列所示转化关系:
![]()
(1)A的化学式为________,E的结构简式:________.
(2)A是一种可以作为药物的有机物,将A在一定条件下氧化可以得到两种有机酸X和Y,X属于芳香族化合物,它在食品保存及染料、药物生产中均有重要作用,则X的结构简式为________.
(3)在上述转化关系中设计步骤A![]() F的目的是________.
F的目的是________.
(4)G![]() H的化学反应类型是________.
H的化学反应类型是________.
(5)在研究过程中该同学发现从A合成E,有一条比上述简便的方法,请你帮助他完成A![]() …
…![]() E的反应流程图(有机物用结构简式表示,必须注明反应条件).
E的反应流程图(有机物用结构简式表示,必须注明反应条件).
提示:①合成过程中无机试剂任选.②反应流程图表示方法示例如下:
A![]() ……
……![]() E
E
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)、据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:

![]() 已知: 一定条件(Ⅰ)RNH2+
已知: 一定条件(Ⅰ)RNH2+CH2Cl →RNHCH2
+HCl(R和
代表烃基);
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ)(苯胺,弱碱性,易氧化)
(Ⅳ)与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
回答下列问题:
(1)C的结构简式是 。
(2)请写出D+E→F的化学方程式: 。
(3)E在一定条件下,可聚合成很好的功能高分子材料,写出合成此高聚物的化学方程式 。
(4)反应①~⑤中,属于取代反应的是(填反应序号)
(5)符合下列条件的E的同分异构体的数目是( )。
①与FeCl3溶液有显色反应 ②能发生银镜反应 ③苯环上的一溴取代物只有3种。
A、3种 B、8种 C、10种 D、12种
(6) 已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),反应方程式如下:
C6H5CHO+ (CH3CO)2O → C6H5CH=CHCOOH+CH3COOH
苯甲醛 肉桂酸
若苯甲醛的苯环上有取代基,也能发生Perkin反应,相应产物的产率如下:
|
反应物
|
|
|
|
|
| 产率(%) | 15 | 23 | 33 | 0 |
|
反应物
|
|
|
|
|
| 产率(%) | 71 | 63 | 52 | 82 |
请根据上表回答:取代基对Perkin反应的影响有(写出3条即可):
①
②
③ [来
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)
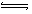 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
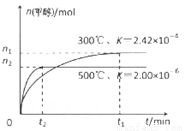
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)
 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省协作体高三5月第二次联考化学试卷(解析版) 题型:计算题
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看答案和解析>>
科目:高中化学 来源:江西省2010届高三适应考试2理综化学 题型:实验题
(16分)、据《中国制药》报道,化合物F是用于制备“非典”药品(盐酸祛炎痛)的中间产物,其合成路线为:

 已知: 一定条件(Ⅰ)RNH2+
已知: 一定条件(Ⅰ)RNH2+ CH2Cl →
RNHCH2
CH2Cl →
RNHCH2 +HCl(R和
+HCl(R和 代表烃基);
代表烃基);
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:
(Ⅲ) (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)
(Ⅳ)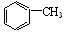 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物
回答下列问题:
(1)C的结构简式是 。
(2)请写出D+E→F的化学方程式: 。
(3)E在一定条件下,可聚合成很好的功能高分子材料,写出合成此高聚物的化学方程式 。
(4)反应①~⑤中,属于取代反应的是(填反应序号)
(5)符合下列条件的E的同分异构体的数目是( )。
①与FeCl3溶液有显色反应 ②能发生银镜反应 ③苯环上的一溴取代物只有3种。
A、3种 B、8种 C、10种 D、12种
(6) 已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45~50%),反应方程式如下:
C6H5CHO + (CH3CO)2O → C6H5CH=CHCOOH +CH3COOH
苯甲醛 肉桂酸
若苯甲醛的苯环上有取代基,也能发生Perkin反应,相应产物的产率如下:
|
反应物
|
|
|
|
|
|
产率(%) |
15 |
23 |
33 |
0 |
|
反应物
|
|
|
|
|
|
产率(%) |
71 |
63 |
52 |
82 |
请根据上表回答:取代基对Perkin反应的影响有(写出3条即可):
①
②
③ [来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com