
| A. | K+ Cl- MnO4- SO42- | B. | Na+ CO32- NO3- SO42- | ||
| C. | Na+ NO3- SO42- HCO3- | D. | Mg2+ SO42- S2- Cl- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
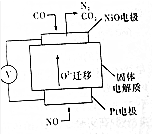
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
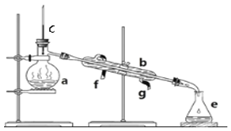 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:4 | B. | 1:1:1 | C. | 4:2:1 | D. | 1:2:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;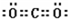 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com