
| A. | 原子半径:W>X>Y>Z>M | |
| B. | XZ2为直线形的共价化合物 | |
| C. | X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键 |
分析 X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,Y与M形成的气态化合物在标准状况下的密度为0.76g/L,M=0.76g/L×22.4L/mol=17,形成化合物为氨气,M为H,Y为N;X与Z可形成XZ2分子,X为C,Z为O;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$,W的质子数为(6+7+8+1)×$\frac{1}{2}$=11,可知W为Na,以此来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为O,M为H,W为Na,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:W>X>Y>Z>M,故A正确;
B.XZ2的结构式为O=C=O,为直线形的共价化合物,故B正确;
C.X、Y、Z 分别与M元素形成的最简单化合物中甲烷不含氢键,氨气与水分子间均含氢键,且水分子形成氢键数目多,则沸点依次升高,故C正确;
D.由X、Y、Z、M四种元素形成的化合物为硝酸时,只含共价键,为硝酸铵时含离子键和共价键,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
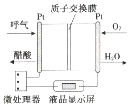
| A. | 电流由呼气所在的铂电极流出 | |
| B. | H+透过质子交换膜流向氧气所在的铂电极 | |
| C. | 电路中流过2mol电子时,消耗11.2LO2 | |
| D. | 该电池的负极反应为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
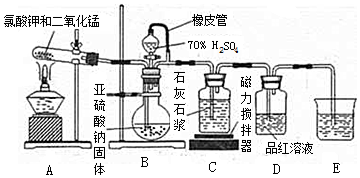
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3,HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液滴加到CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、Al3+、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com